
| A£® | ÉżøßĪĀ¶Č£¬H2SÅضČŌö¼Ó£¬±ķĆ÷øĆ·“Ó¦µÄ”÷H£¾0 | |
| B£® | Ėę×Å·“Ó¦µÄ½ųŠŠ£¬»ģŗĻĘųĢåµÄĆܶČÖš½„¼õŠ” | |
| C£® | ·“Ó¦Ē°H2SĪļÖŹµÄĮæĪŖ7mol | |
| D£® | COµÄĘ½ŗā×Ŗ»ÆĀŹĪŖ80% |
·ÖĪö A£®ÉżøßĪĀ¶Č£¬H2SÅضČŌö¼Ó£¬ĖµĆ÷Ę½ŗāÄęĻņŅĘ¶Æ£¬ÉżøßĪĀ¶Č£¬Ę½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ£»
B£®ĘųĢåÖŹĮæ²»±ä£¬ŌņĆÜ¶Č²»±ä£»
C£®·“Ó¦Ē°COµÄĪļÖŹµÄĮæĪŖ10mol£¬Ę½ŗāŗóCOĪļÖŹµÄĮæĪŖ8mol£¬Éč·“Ó¦Ē°H2SĪļÖŹµÄĮæĪŖn£¬Ōņ£ŗ
CO£Øg£©+H2S£Øg£©?COS£Øg£©+H2£Øg£©
ĘšŹ¼£Ømol£©£ŗ10 n 0 0
±ä»Æ£Ømol£©£ŗ2 2 2 2
Ę½ŗā£Ømol£©£ŗ8 n-2 2 2
·“Ó¦Ē”ŗĆĘųĢå·Ö×ÓŹżÄæ²»±ä£¬ĄūÓĆĪļÖŹµÄĮæ“śĢęÅØ¶Č“śČėĘ½ŗā³£Źż±ķ“ļŹ½K=$\frac{c£ØCOS£©”Įc£Ø{H}_{2}£©}{c£ØCO£©”Įc£Ø{H}_{2}S£©}$ĮŠ·½³Ģ¼ĘĖć£»
D£®øł¾ŻCÖŠµÄ¼ĘĖ揿¾Ż¼ĘĖćCOµÄĘ½ŗā×Ŗ»ÆĀŹ£®
½ā“š ½ā£ŗA£®ÉżøßĪĀ¶Č£¬H2SÅضČŌö¼Ó£¬ĖµĆ÷Ę½ŗāÄęĻņŅĘ¶Æ£¬ÉżøßĪĀ¶Č£¬Ę½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ£¬ŌņøĆ·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬¹ŹA“ķĪó£»
B£®ĘųĢåÖŹĮæ²»±ä£¬ĒŅĢå»ż²»±ä£¬ŌņĆÜ¶Č²»±ä£¬¹ŹB“ķĪó£»
C£®·“Ó¦Ē°COµÄĪļÖŹµÄĮæĪŖ10mol£¬Ę½ŗāŗóCOĪļÖŹµÄĮæĪŖ8mol£¬Éč·“Ó¦Ē°H2SĪļÖŹµÄĮæĪŖn£¬Ōņ£ŗ
CO£Øg£©+H2S£Øg£©?COS£Øg£©+H2£Øg£©
ĘšŹ¼£Ømol£©£ŗ10 n 0 0
±ä»Æ£Ømol£©£ŗ2 2 2 2
Ę½ŗā£Ømol£©£ŗ8 n-2 2 2
·“Ó¦Ē”ŗĆĘųĢå·Ö×ÓŹżÄæ²»±ä£¬ĄūÓĆĪļÖŹµÄĮæ“śĢęÅØ¶Č“śČėĘ½ŗā³£Źż±ķ“ļŹ½K=$\frac{c£ØCOS£©”Įc£Ø{H}_{2}£©}{c£ØCO£©”Įc£Ø{H}_{2}S£©}$=$\frac{2”Į2}{8”Į£Øn-2£©}$=0.1£¬½āµĆn=7£¬¹ŹCÕżČ·£»
D£®øł¾ŻÉĻŹöŹż¾Ż£¬æÉÖŖCOµÄĘ½ŗā×Ŗ»ÆĀŹĪŖ$\frac{2mol}{10mol}$”Į100%=20%£¬¹ŹD“ķĪó£®
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²éÓ°Ļģ»Æѧ·“Ó¦ĖŁĀŹµÄŅņĖŲ”¢»ÆŃ§Ę½ŗā³£ŹżÓ¦ÓĆ”¢»ÆŃ§Ę½ŗāµÄÓŠ¹Ų¼ĘĖć£¬ĪŖøßĘµæ¼µć£¬²ąÖŲæ¼²éѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦£¬×¢ŅāĄķ½āÕĘĪÕČż¶ĪŹ½¾ł½āĢā·ØŌŚ»ÆŃ§Ę½ŗā¼ĘĖćÖŠµÄÓ¦ÓĆ£¬ÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | v£ØA£©=0.5 mol/£ØL•s£© | B£® | v£ØB£©=0.3mol/£ØL•s£© | C£® | v£ØC£©=0.6 mol/£ØL•s£© | D£® | v£ØD£©=1 mol/£ØL•s£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ca | B£® | Fe | C£® | Cu | D£® | P |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ū¢Ü¢Ż¢Ž | B£® | ¢Ū¢Ü¢Ž¢ß | C£® | ¢Ł¢Ś¢Ž¢ß | D£® | ¢Ś¢Ū¢Ü¢Ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
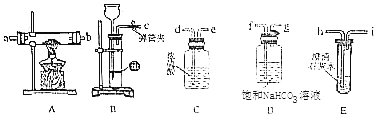
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1 | B£® | 2 | C£® | 3 | D£® | 4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃ鱹ŗÅ | T£Ø”ę£© | n£ØCO£©/n£ØH2£© | P£ØMPa£© |
| 1 | 180 | $\frac{2}{3}$ | 0.1 |
| 2 | n | $\frac{2}{3}$ | 5 |
| 3 | 350 | m | 5 |
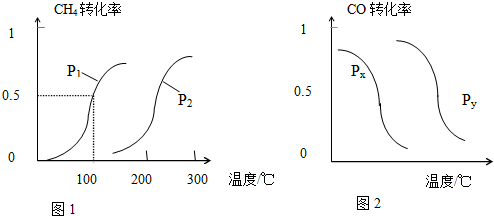
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
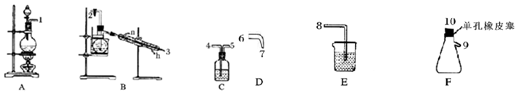
| ĪļĄķŠŌÖŹ | ÖʱøŌĄķ | »ÆѧŠŌÖŹ |
| »ĘÉ«ÓĶדŅŗĢ壬ČŪµćĪŖ-40”ę£¬·ŠµćĪŖ71”ę£¬²»ČÜÓŚĄäĖ®£¬Ņ×ČÜÓŚÓŠ»śČܼĮ£¬ĆܶČĪŖ1.65g/mL | Cl2ÓėNH4ClĖ®ČÜŅŗŌŚµĶĪĀĻĀ·“Ó¦ | 95”걬ÕØ£¬ČČĖ®ÖŠÄÜÓėĖ®·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com