
| A. | X只有1种结构 | |
| B. | 雌性信息素可能是烯烃,会使溴水褪色 | |
| C. | 电解的阳极反应式为:C21H41COOH+X+2H2O-2e-→C23H46+2CO32-+6H+ | |
| D. | 阴极的还原产物为H2 |
分析 A、根据原子守恒确定X的分子式和结构;
B、雌性信息素的分子式为C23H46,符合CnH2n的通式;
C、在浓NaOH溶液中进行电解时,不可能生成氢离子;
D、阴极发生的是得电子的还原反应;
解答 解:A、根据原子守恒可知X为C2H5COOH,即丙酸,只有一种结构,故A正确;
B、雌性信息素的分子式为C23H46,符合CnH2n的通式,可能是烯烃或环烷烃,如果是烯烃则能使溴水褪色,故B正确;
C、电解质溶液为浓NaOH,不可能得到氢离子,阳极反应式应为C21H41COOH+X-2e-+6OH-→C23H46+2CO32-+4H2O,故C错误;
D、阴极是氢离子放电,还原产物是氢气,故D正确;
故选C.
点评 本题考查了电解原理、氧化还原反应等,难度中等,考查学生对知识掌握与综合利用、分析解决问题的能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑧ | B. | ⑤⑧ | C. | ②⑤⑥⑦ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和乙胺反应属于加成反应 | |
| B. | 室溫离子可以使熔盐燃料电池在常溫下工作 | |
| C. | CH3CH2NO3中,只有σ键没有π键 | |
| D. | 融化CH3CH2•NO3晶体需要破坏分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
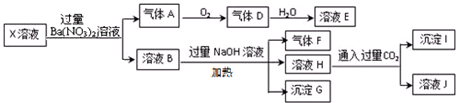
| A. | X中肯定存在Fe2+、A13+、NH4+、C1- | |
| B. | X中不能确定的离子是 K+和C1- | |
| C. | 沉淀G在空气中放置过程中,沉淀颜色会由白色变为灰绿色最后变为红褐色 | |
| D. | 标准状况下将一试管D气体倒扣在水槽中充分吸收(假设所得溶液没有扩散),所得溶液物质的量浓度约为0.036mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr 151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| A. | a、b、c、d的化学式分别为Ne、Br2、HF、H2Se | |
| B. | 系列②中各物质均只有强氧化性 | |
| C. | 系列④中各化合物的稳定性顺序为:H2O>H2S>d>H2Te | |
| D. | 系列③中各物质对应物质水溶液的酸性和还原性均逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com