

| A、利用图1制取并收集干燥的氨气 |
| B、利用图2制取Fe(OH)2,使用煤油的目的是防止生成的Fe(OH)2被空气氧化 |
| C、利用图3制取并收集NO2气体 |
| D、利用图4用酒精制取无水乙醇 |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、等物质的量的Na2CO3和CH3COOH两种溶液混合,一定 有:c(Na+)+c(H+)=2c(CO32-)+c (HCO3-)+c (CH3COO-) |
| B、常温下,已知酸H2A存在如下平衡:H2A?H++HA-;HA-?H++A2-(Ka1=5.9xl0-2,Ka2=6.4xl0'6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 |
| C、相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c (Na+)>c (ClO-)>c (CH3COO-)>c (OH-)>c (H+) |
| D、常温下,在O.lmol/LCH3COOH溶液中滴加O.lmol/LNaOH的溶液发生反应,当c(CH3COOH):c (CH3COO-)=5:9时,此时溶液pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、按系统命名法命名时,(图1)化合物的名称是2,4,6-三甲基-5-乙基庚烷 |
| B、有机物(图2)的一种芳香族同分异构体能发生银镜反应 |
| C、高分子化合物(图3),其单体为对苯二甲酸和乙醇 |
| D、等质量的乙炔和苯完全燃烧生成水的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将二氧化碳通人硅酸钠溶液以证明碳酸的酸性比硅酸强 |
B、如图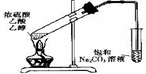 装置中,导管不能伸人液面的原因是产物易溶于水 装置中,导管不能伸人液面的原因是产物易溶于水 |
| C、用碱石灰可干燥氯气 |
| D、用普通玻璃棒蘸取溶液做焰色反应以证明溶液含有Na十 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 室温下,向0.1mol?L-1NaAlO2溶液中逐滴加入0.1mol?L-1稀盐酸,实验测得溶液pH随盐酸体积变化的曲线如图,下列有关说法正确的是( )
室温下,向0.1mol?L-1NaAlO2溶液中逐滴加入0.1mol?L-1稀盐酸,实验测得溶液pH随盐酸体积变化的曲线如图,下列有关说法正确的是( )A、a点时,溶液呈碱性的原因是Al
| ||||
B、a→b段,溶液pH减小,Al
| ||||
| C、b→c段,加入的盐酸主要用于生成Al(OH)3沉淀 | ||||
| D、d点时,Al(OH)3沉淀开始溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、润洗酸式滴定管时应从滴定管上口加入3?5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润 湿其内壁,再从上口倒出,重复2?3次 | ||
B、向酒精灯内添加酒精时,不能多于容积的
| ||
| C、探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合 | ||
| D、在“金属析氢腐蚀”实验中,外面缠绕着铜丝的铁钉上产生气泡多,在铁钉周围出现血红色现象(溶液中滴加几滴KSCN溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2- | 5.2 | 4.1 |
| A、第一组反应pH升高是因为O3氧化I的反应是消耗H+的过程 |
| B、物质A可能是Fe2+ |
| C、Fe2+生成A的过程中,I的转化率显著提高的原因可能是溶液酸性增强,使②、③步骤平衡右移,转化率提高 |
| D、第2组实验18s后,c(I3-)下降的其中一个原因可能是I2(g)的不断生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 信息 |
| B | 其单质在常温下为双原子分子,与A可形成分子X,X的水溶液呈碱性 |
| D | 其氧化物具有两性 |
| E | 元素原子最外层比次外层少2个电子 |
| C、F | 两种元素的原子最外层共有13个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4 |
| B、C2H4 |
| C、C4H4 |
| D、C3H6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com