
(14分)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知: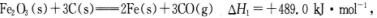
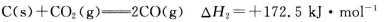
则CO还原Fe2O3(s)的热化学方程式为_________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_________ 。
(3)CO2和H2充人一定体积的密闭容器中,在两种温度下发生反应:
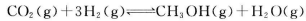 测得CH3OH的物质的量随时间的变化见图1。
测得CH3OH的物质的量随时间的变化见图1。
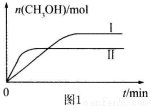
①曲线I、Ⅱ对应的平衡常数大小关系为 (填“>”或“=”或“<”)。
(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
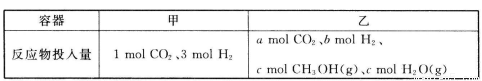
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为_________。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(工、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2。在O~15小时内,CH4的平均生成速率工、Ⅱ和Ⅲ从大到小的顺序为_________(填序号)。
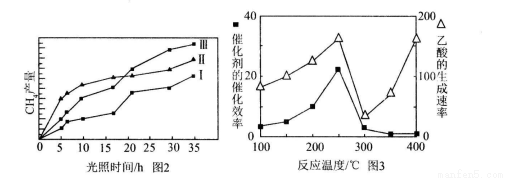
(5)以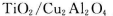 为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________________________________.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:________________________________。
科目:高中化学 来源:2014-2015学年湖南省长沙市高三5月一模化学试卷(解析版) 题型:选择题
根据表中信息,判断下列叙述中正确的是
序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① | Cl2 | FeBr2 | / | Cl- | |
② | KClO3 | 浓盐酸 | / | Cl2 | |
③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应只可能有一种元素被氧化和一种元素被还原
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.由表中①②组反应推测:ClO3-、Br-、H+、Fe2+不能在浓溶液中大量共存
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三综合能力测试(五)理综化学试卷(解析版) 题型:推断题
【化学──选修5:有机化学】(15分)龙胆酸烷基酯类F是一种药物皮肤美白剂,合成路线如下:
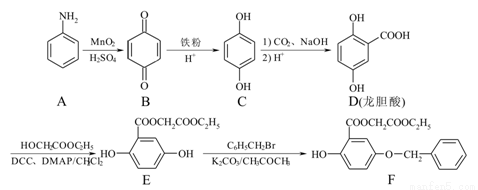
(1)D(龙胆酸)中含氧官能团的名称为 、 。
(2)E F的反应类型是 。
F的反应类型是 。
(3)写出D E反应的化学方程式: 。
E反应的化学方程式: 。
(4)写出满足下列条件的龙胆酸乙酯(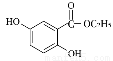 )的一种同分异构体结构简式: 。
)的一种同分异构体结构简式: 。
Ⅰ.能发生银镜反应,与FeCl3不发生显色反应但其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.核磁共振氢谱有四组峰,且峰的面积之比为6:2:1:1。
(5)已知: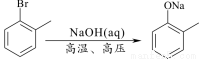 。水杨酸乙酯(
。水杨酸乙酯(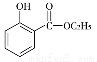 )广泛应用于日用香皂等。根据已有知识并结合相关信息,写出以苯、乙醇为原料制备水杨酸乙酯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
)广泛应用于日用香皂等。根据已有知识并结合相关信息,写出以苯、乙醇为原料制备水杨酸乙酯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
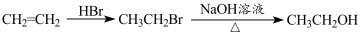
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三二模考试理综化学试卷(解析版) 题型:实验题
(13分)过氧化钙是一种新型的多功能无机化工产品,常温下是无色或淡黄色粉末,易溶于酸。难溶于水、乙醇等溶剂。某实验小组在实验室用钙盐制取Ca02·8H20沉淀(该反应是一个放热反应)。
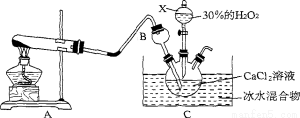
(1)仪器X的名称是 。将装置A与B连接后要检查气密性,检查气密性的方法为
(2)仪器B的作用是 。
(3)写出A中发生反应的化学方程式: 。
(4)制取CaO2·8H20一般在0~5℃的低温下进行,原因是 .生成CaO2·8H20的 化学方程式为 。
(5)2.76 g CaO2·8H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线,140℃时完全脱水,杂质受热不分解)如图所示。
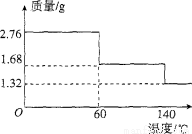
①试确定60℃时CaO2·xH20中x= 。
②该样品中CaO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三二模考试理综化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关.下列有关叙述正确的是
A.泡沫灭火器中用的是苏打和硫酸铝
B.通过干馏可将煤中含有的苯、甲苯等物质分离出来
C.地沟油通过水解反应可得到车用汽油
D.家庭用洁厕灵与"84消毒液”不能同时使用
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
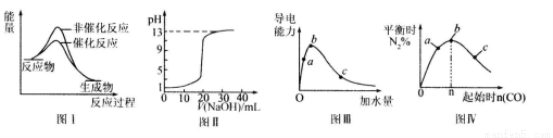
A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0. 100 mol/L NaOH溶液滴定20. 00 mL、0.100 mol/L HC1溶液所得到的滴定曲线。
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b
D.图Ⅳ表示反应 ,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:填空题
(14分)醇是重要的有机化工原料。一定条件下,甲醇可同时发生下面两个反应:
i .2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ii.2CH3OH(g) C2H4(g)+2H2O(g)
C2H4(g)+2H2O(g)
I.上述反应过程中能量变化如图所示:
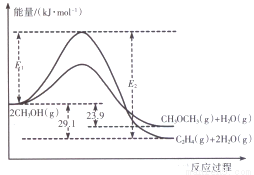
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应________(填“i”或“ii”)的速率较大,其原因为___________。若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:E1__________;E2-E1___________(填“增大”、“减小”或“不变”)。
(2)已知:CH3CH2OH(g)=CH3OCH3(g) H=+50.7 kJ·mol-1。则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的H= 。
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2 L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
起始投料 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
恒温容器1 | 2 | 0 | 0 |
恒温容器2 | 0 | 2 | 2 |
绝热容器3 | 2 | 0 | 0 |
(3)比较平衡时容器1中c1(H2O)和容器2中c2(H2O)的大小:c1(H2O)________c2(H2O)(填 “>”、“<”或“=”);三个容器中反应的化学平衡常数分别记为K1、K2和K3,三者的大小关系为__________。
(4)若容器l中平衡时CH3OH(g) 的转化率为80%,则该温度下反应i的平衡常数K=______________ .
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
a-5X、b-3Y、aZ、bW、a+4T均为短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的金属元素,W原子最外层电子数是K层电子数的2倍。则下列说法正确的是
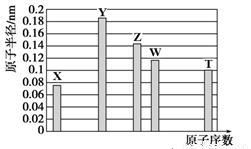
A.Z、T两种元素的离子半径相比,前者较大
B.X、Y形成的两种化合物中,阴、阳离子物质的量之比分别为1∶1和1∶2
C.X、W、T三种元素的气态氢化物中,稳定性最差的是W的氢化物,沸点最高的是T的氢化物
D.Y、T两种元素的最高价氧化物对应的水化物均能溶解X和Z形成的常见化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B、C物质的量变化如图(Ⅰ)所示.若保持其它条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如图(Ⅱ)所示.下列叙述正确的是( )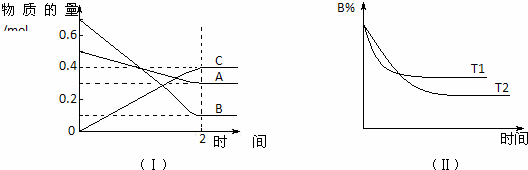
|
| A. | 2 min内A的化学反应速率为0.1 mol/(L•min) |
|
| B. | 在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动 |
|
| C. | 在反应达平衡时,其它条件不变,升高温度,正逆反应速率都增大,且A的转化率增大 |
|
| D. | 在T℃时,若A的浓度减少了1 mol/L,则B的浓度会减少3 mol/L,C的浓度会增加2 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com