
研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为 而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H K ①
已知:N2(g)+3H2(g)=2NH3(g)△H1=﹣92.4kJ•mol﹣1 K1 ②
2H2(g)+O2(g)=2H2O(l)△H2=﹣571.6kJ•mol﹣1 K2 ③
则△H= ;K= (用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3小时,实验数据见下表:
序号 | 第一组 | 第二组 | 第三组 | 第四组 | ||||||||||
t/℃ | 30 | 40 | 50 | 80 | ||||||||||
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 | ||||||||||
下列能说明反应①达到平衡状态的是 (填字母)。K]
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为 ;与前三组相比,第四组反应中NH3生成量最小的原因可能是 。
 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源:2015-2016学年广东仲元中学高二下期末理综化学试卷(解析版) 题型:选择题
下列实验操作正确且能达到预期目的的是
实验目的 | 操作 | |
A | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液 |
B | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
C | 欲证明CH3CH2Cl中的氯原子 | 取CH3CH2Cl在碱性条件下的水解液适量于试管,先加足量硝酸酸化,再滴入少量AgNO3溶液 |
D | 证明乙醇在浓硫酸加热条件下的产物是乙烯 | 将产生的气体通入酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津静海一中等校高一下期末化学试卷(解析版) 题型:选择题
酸燃料电池以Ca(HSO2)2固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是
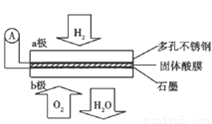
A.电子通过外电路从a极流向b极
B.b极上的电极反应式为:O2+4H+=+4e+=2H2O
C每转移0.4mol电子,生成3.6g水
D.H+由b极通过固体酸电解质传递到a极
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津静海一中等校高一下期末化学试卷(解析版) 题型:选择题
下列表示正确的是
A.CH4的球棍模型示意图为
B.H2O2的电子式: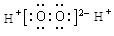
C.葡萄糖的最简式为CH2O
D.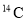 的原子结构示意图:
的原子结构示意图: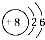
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高二下期末化学试卷(解析版) 题型:推断题
【化学——选修5:有机化学基础】龙葵醛(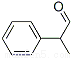 )是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
)是一种珍贵的香料,广泛应用于香料、医药、染料及农药等行业。以下是以苯为原料生成龙葵醛的一种合成路线(部分反应条件及副产物已略去):
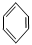
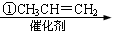
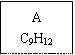

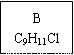

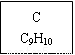
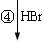
龙葵醛
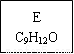

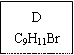
(1)龙葵醛的分子式为 ,其中含氧官能团的名称是 ;A物质得到的1H-NMR谱中有
个吸收峰,B的结构简式可能为 。
(2)反应③的反应类型为 ,反应⑤的反应条件为 。
(3)反应⑥的化学方程式为 。
(4)龙葵醛具有多种同分异构体,其中某些物质有下列特征:a.其水溶液遇FeCl3溶液呈紫色;b.苯环上的一溴代物有两种;c.分子中没有甲基。写出符合上述条件的物质可能的结构简式(只写两种):_________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高二下期末化学试卷(解析版) 题型:选择题
有关下图所示化合物的说法不正确的是 ( )
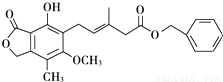
A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高二下期末化学试卷(解析版) 题型:选择题
X、Y、Z、M代表四种金属元素.金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子.则这四种金属的活动性由强到弱的顺序为( )
A.X>Y>Z>M B. X>Z>Y>M C. M>Z>X>Y D. X>Z>M>Y
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省松原市高一下期末化学试卷(解析版) 题型:选择题
金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2n H2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法正确的是
H2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法正确的是
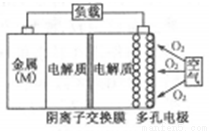
A.比较Mg、Al、Zn三种金属–空气电池,Mg–空气电池的理论比能量最高
B.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
C.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
D.在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用酸性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省松原市高二下期末化学试卷(解析版) 题型:选择题
在下列溶液中,各组离子一定能够大量共存的是( )
A.某强酸性溶液:Na+、Fe2+、Cl-、ClO-
B.含有大量S2-的溶液:ClO-、Na+、Cl-、Fe2+
C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+
D.加入铝粉能放出大量H2的溶液:K+、NH4+、SO42-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com