
【题目】下图为甲同学设计的制取并检验C2H4性质的实验装置图。请回答有关问题:
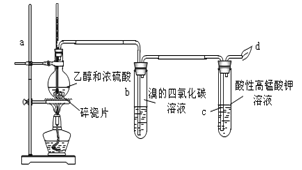
(1)写出上述制乙烯的反应的化学方程式: ,
(2)加入几片碎瓷片的目的是 ,
(3)加热时,使混合液温度迅速升高到170℃,是为了 ,
(4)实验过程观察到的现象为:
①Br2的四氯化碳溶液由 色变 ,
②酸性KMnO4溶液 。
(5)乙同学认为甲同学设计的实验如果仅从酸性KMnO4溶液褪色难以证明反应有乙烯生成,因为反应产生的乙烯中可能混有 气体也能使酸性KMnO4溶液褪色。写出此气体使酸性KMnO4溶液褪色的离子方程式 。
【答案】(1)![]()
(2)防止液体受热暴沸
(3)防止乙醇与浓硫酸在140℃时发生副反应,生成乙醚
(4)①橙红无②褪色
(5)SO2![]()
【解析】
试题分析:(1)乙醇和浓硫酸加热到170℃制取乙烯,制乙烯的反应的化学方程式:![]()
(2)加入几片碎瓷片的目的是防止液体受热暴沸,
(3)加热时,乙醇与浓硫酸在140℃时发生反应生成乙醚,使混合液温度迅速升高到170℃,是为了防止乙醇与浓硫酸在140℃时生成乙醚,
(4)实验过程观察到的现象为:
①乙烯与溴发生加成反应,Br2的四氯化碳溶液由橙红色变无,
②乙烯能被酸性高锰酸钾氧化,酸性KMnO4溶液褪色。
(5)浓硫酸能使乙醇脱水碳化,碳和浓硫酸反应生成二氧化碳、二氧化硫、水,如果仅从酸性KMnO4溶液褪色难以证明反应有乙烯生成,因为反应产生的乙烯中可能混有SO2气体也能使酸性KMnO4溶液褪色。二氧化硫气体使酸性KMnO4溶液褪色的离子方程式![]() 。
。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】I.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 。
(2)液氨是富氢物质,是氢能的理想载体,利用![]() 2NH3实现储氢和输氢。下列说法正确的是 。
2NH3实现储氢和输氢。下列说法正确的是 。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化 b.电负性顺序:C<N<O<F
c.由于氨分子间存在氢键,所以稳定性:NH3>PH3 d.[Cu(NH3)4]2+中N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是 。
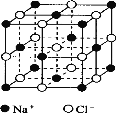
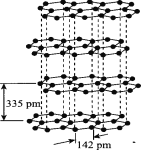
Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示:
(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则该Na+与跟它次近邻的Cl-的个数为 ,该Na+与跟它次近邻的Cl-之间的距离为 。
(2)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为 (用含a、b的式子表示)。
(3)硅与碳是同主族元素,其中石墨为混合型晶体,已知石墨的层间距为335 pm,C--C键长为142 pm,则石墨晶体密度约为 (列式并计算,结果保留三位有效数字,NA为6.02×1023 mol-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,A元素有三个电子层,其中最外层电子数占总电子数的1/6;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍.请填写下列空格:
(1)请写出A的元素符号______;
(2)C的阴离子的结构示意图______;
(3)C、D两元素形成的化合物的电子式__________________________。
(4)A、B两元素相比较,A元素的活泼性较强,可以验证该结论的实验是( )
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试液
D.比较这两种元素的气态氢化物的热稳定性.
(5)写出D的氢化物与C的单质1:2反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(l)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置乙中正极的电极反应式是 。
②四种金属活动性由强到弱的顺序是 。
(2)由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向 (填“正极”或“负极’) 。负极的电极反应式是 , 标准状况下生成 L气体。
(3)断开1 mol H一H键、1 mol N一H键、1 mol N≡N 键分别需要吸收能量为436KJ、391KJ、946KJ,求:H2与N2反应生成0.5 molNH3填(“吸收”或“放出”)能量 KJ。
(4)原子序数大于4的主族元素A和B的离子分别为Am+和Bn-,已知它们的核外电子排布相同,据此推断:
① A和B所属周期数之差为(填具体数字) 。
② A和B的核电荷数之差为(用含m或n的式子表示) 。
③ B和A的族序数之差为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A分子中含苯环,相对分子质量136,分子中碳、氢原子个数相等,其含碳质量分数为70.6%,其余为氧、氢。
(1)A的分子式是__________________。
(2)若A分子中能发生银镜反应,且有弱酸性,则A的同分异构体有_______种,请任写一种符合条件的A的结构简式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙炔常因含杂质生成少量H2S,有人设计了下列实验以确证上述混合气体中含有乙炔和H2S。
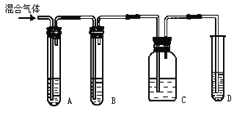
(1)如图所示A、B、C、D装置中可盛放的试剂是(填序号)
A.________; B.________; C.________; D.______。
①CuSO4溶液 ②NaOH溶液 ③溴水 ④KMnO4酸性溶液
(2)能说明H2S气体存在的现象是___ _____,
(3)使用装置B的目的是______ _,
(4)使用装置C的目的是___ ,
(5)确证含有乙炔的现象是___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学~选修2:化学与技术]
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素。从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害。下图是用高炉烟尘制取硫酸锌的工业流程。

已知:①20℃时,0.1 mol.L-1的金属离子沉淀时的pH

②过二硫酸铵是一种强氧化剂。
![]()
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?
(举出1种) 。
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是 。
(3)加入MnO2的目的是 。
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式 。
(5)写出还原过程发生的主要反应的离子方程式 。
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是 。
A锌粉 B氨水 C( NH4)2CO3 D NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1) 3,3-二甲基-4-乙基庚烷
结构简式为_______________________________________。
(2)3-甲基-2-乙基-1-戊烯
结构简式为________________________________________。
(3)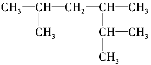
名称为_______________________________________。
(4)![]()
名称为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】
NaCl是价廉且应用广泛的化工业原料,例如应用于纯碱工业、氯碱工业、氯酸钾工业、肥皂工业等。
(1)19世纪60年代氨碱法是纯碱工业广泛使用的方法,20世纪20年代以后被联合制碱法逐渐取代。
①请写出以NaCl为原料利用氨碱法生产纯碱的化学方程式_____________________。
②在联合制碱法中,纯碱工厂与______________工厂进行联合生产,以方便的获得原料_________________。
③在联合制碱法中循环使用,而在氨碱法中循环使用率不高的物质是_______________。
(2)氯酸钾是重要的化工业产品,在火柴、炸药、雷管、焰火等制造中有重要应用,工业中首先通过电解热食盐水制得氯酸钠,再加入一定量的氯化钾即可得到氯酸钾沉淀。
①在火柴、炸药、雷管、焰火的制造过程中大量使用氯酸钾,主要应用氯酸钾的___________性。
②请写出电解食盐水生产氯酸钠的化学方程式__________________。该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有____________________(请答出两点)。
(3)在肥皂的工业生成过程中,也要使用NaCl的目的是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com