
分析 (1)Ni原子核外电子数为28,根据能量最低原理书写;
(2)根据分子极性判断,分子极性越大,熔点越高;孤对电子与成键电子对之间排斥>成键电子-成键电子排斥,键角被压缩;
(3)CO分子与N2互为等电子体,CO结构式为C≡O;Ni(CO)m的熔点是173℃,熔融状态不导电,则该化合物属于分子晶体;
(4)SO42-中S原子杂化轨道数目为4+$\frac{6+2-2×4}{2}$=4;
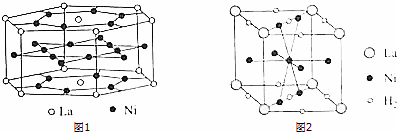
(5)根据均摊法计算晶胞中La、Ni原子数目,确定原子数目之比;
根据均摊法计算储氢后晶体中La、Ni、H2数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算.
解答 解:(1)Ni原子核外电子数为28,核外电子排布式为1s22s22p63s23p63d84s2,其价电子排布式为:3d84s2;
故答案为:3d84s2;
(2)CO与N2相对分子质量相等,N2是非极性分子,CO是极性分子,分子间作用力增大,故CO的熔点比N2熔点高,
铵根离子中含有4个键,没有孤电子对,氮原子采取sp3杂化,氨气分子中氮原子上有一对孤电子对,铵根离子中氮原子上没有孤电子对,排斥力小,故NH3中H-N-H键角比NH4+中H-N-H键角小,
故答案为:N2是非极性分子,CO是极性分子,分子间作用力增大;氨气分子中氮原子上有一对孤电子对,铵根离子中氮原子上没有孤电子对,排斥力小;
(3)CO分子与N2互为等电子体,CO结构式为C≡O,CO分子中σ键与π键的个数比为1:2,Ni(CO)m的熔点是173℃,熔融状态不导电,则该化合物属于分子晶体,
故答案为:1:2;分子;
(4)SO42-中S原子杂化轨道数目为4+$\frac{6+2-2×4}{2}$=4,S原子采取sp3杂化,
故答案为:sp3杂化;
(5)晶胞中La原子数目为12×$\frac{1}{6}$+2×$\frac{1}{2}$=3、Ni原子数目为6+18×$\frac{1}{2}$=15,则镧镍合金中镧原子与镍原子的原子个数比为3:15=1:5,
晶胞中La原子数目为8×$\frac{1}{8}$=1、Ni原子数目为1+8×$\frac{1}{2}$=5、H2数目为8×$\frac{1}{4}$+2×$\frac{1}{2}$=4.5,合金化学式为LaNi5H4.5,储氢后晶体的摩尔质量为Mg/mol,则储氢后晶体晶胞质量为$\frac{M}{{N}_{A}}$g,任意两个距离最近的La原子之间的距离均为a cm,则氢后晶体密度可表示为$\frac{\frac{M}{{N}_{A}}g}{(acm)^{3}}$=$\frac{M}{{N}_{A}{a}^{3}}$g.cm-3,
故答案为:$\frac{M}{{N}_{A}{a}^{3}}$g.cm-3.
点评 本题是对物质结构的考查,涉及核外电子排布、化学键、分子性质、杂化轨道、晶胞计算,(5)注意利用均摊法计算解答,难度中等.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 一种物质被氧化,必有另一种物质被还原 | |
| B. | CO2的水溶液可以导电,所以CO2是电解质 | |
| C. | Na2O2可用作呼吸面具中的供氧剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 乙的常见氧化物只有一种 | |
| B. | 气态氢化物稳定性:丙>丁 | |
| C. | 原子半径大小:戊<丙 | |
| D. | 丙的氧化物能与戊的氢化物的水溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若该反应的△H<0,升高温度,平衡常数K减小 | |
| B. | 若增大X的浓度,则物质Y的转化率减小 | |
| C. | 以X浓度变化表示的反应速率为$\frac{1}{8}$ mol/(L•s) | |
| D. | 12 s后将容器体积扩大为10 L,Z的平衡浓度变为原来的$\frac{1}{5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2OHCHOHCHOHCHO | B. | CH2OHCHOHCHOHCH2CHO | ||
| C. | CH2OHCHO | D. | CH2OH(CHOH)3COCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 6 | C. | 8 | D. | 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
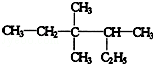 3,3,4-三甲基已烷
3,3,4-三甲基已烷 ,
,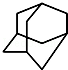 的分子式为C10H16,1mol该烃完全燃烧,需要标准状况下氧气313.6升;该烃的一溴取代物有2种.
的分子式为C10H16,1mol该烃完全燃烧,需要标准状况下氧气313.6升;该烃的一溴取代物有2种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com