
【题目】如图是某另类元素周期表的一部分,下列说法正确的是( )
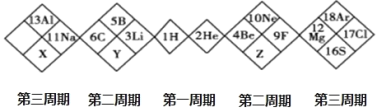
A. 单质的氧化性:X>Y>ZB. 简单阴离子的半径大小:X>Y>Z
C. Y 只有一种氢化物D. X 的最高价氧化物对应的水化物为强酸
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A元素的某种同位素原子没有中子,D元素的原子序数是C的2倍,E是短周期主族元素中半径最大的元素。下列说法不正确的是
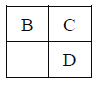
A. 简单离子的半径大小关系:B>C>E
B. D、E两种元素形成的化合物,可能含有离子键和共价键
C. A、B、C三种元素形成的化合物的水溶液均显酸性
D. D、E分别和C形成的化合物,均可能使溴水或品红溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是_________(填元素名称),各元素的第一电离能由大到小的顺序为___________________。
(2)(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_______。
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为为376 K,其固体属于_________晶体。
(4)下图是金属单质常见的两种堆积方式的晶胞模型。

①铁采纳的是a堆积方式.铁原子的配位数为_____,该晶体中原子总体积占晶体体积的比值为_________(用含π的最简代数式表示)。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为__________g·cm-3(用含有r、NA的最简代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把8.0g铁粉投入40mL某HNO3溶液中,充分反应后剩余固体2.4g,产生NO2和NO的混合气体0.12mol。若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度( )
A.6.0mol·L-1B.7.0mol·L -1C.8.0mol·L -1D.9.0mol·L -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
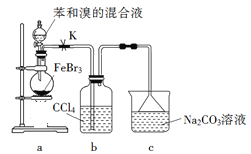
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是___(填序号)
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)如图是从海水中提取镁的简单流程。
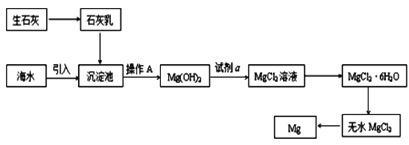
①操作 A是___。
②海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?___
(3)利用海底的“可燃冰”制作的酸性燃料电池的总反应式为:CH4+2O2=CO2+2H2O,则该燃料电池负极的电极反应式为____。
(4)海带灰中富含以 I- 形式存在的碘元素,实验室提取 I2的途径如图所示:
![]()
①灼烧海带至灰烬时所用的主要仪器是____(填序号)。
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式____。
(5)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示,a,b,c,d 括号内数据表示坐标。
CH3OH(g)+H2O(g),某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示,a,b,c,d 括号内数据表示坐标。
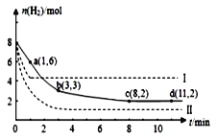
①a点正反应速率___(填“大于、等于或小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是____mol/L。
③能够说明该反应达到化学平衡状态的标志是___。
A.单位时间内消耗1molCO2,同时生成3molH2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。下列说法正确的是
A.12g金刚石中含有的共价键数目为4NA
B.3.2gCu与足量浓硝酸反应生成的气体分子数为0.1NA
C.标准状况下,2.24LCH3OH中含有的电子数为1.8NA
D.常温常压下,4.4gN2O和CO2的混合气体中含有0.3NA个原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com