
 常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,滴定曲线如图所示:
常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,滴定曲线如图所示:| A. | 三种溶液各取10 mL混合,然后滴定,沉淀先后顺序为Cl-、Br-、I- | |
| B. | 滴定Cl-时,可加人少量的KI作指示剂 | |
| C. | 当滴定AgNO3溶液至70.00mL时,溶液中c(I-)>c (Br-)>c(Cl-) | |
| D. | 滴定曲线①、②、③分别表示NaI溶液、NaBr溶液、NaCl溶液 |
分析 常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,分别形成沉淀AgCl,AgBr,AgI,三种沉淀是同类型沉淀,可直接根据Ksp数值比较其溶解性情况,Ksp数值越小,则溶解度越小,结合图象分析.
解答 解:常温下,体积均为50.00mL、浓度均为0.1000mol/L的NaCl、NaBr及NaI三种溶液,分别用0.1000mol/L的AgNO3溶液滴定,分别形成沉淀AgCl,AgBr,AgI,三种沉淀是同类型沉淀,可直接根据Ksp数值比较其溶解性情况,Ksp数值越小,则溶解度越小,
A.三种溶液各取10 mL混合,然后滴定,由于Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl),溶度积常数小的优先沉淀,所以沉淀先后顺序为I-、Br-、Cl-,故A错误;
B.若滴定Cl-时,选用KI做指示剂,则滴定优先产生AgI,不会先产生AgCl,达不到滴定Cl-的目的,故B错误;
C.当滴定AgNO3溶液至70.00mL时,此时溶液中Ag+过量,c(I-)=$\frac{{K}_{sp}(AgI)}{c(A{g}^{+})}$,c(Br-)=$\frac{{K}_{sp}(AgBr)}{c(A{g}^{+})}$,c(Cl-)=$\frac{{K}_{sp}(AgCl)}{c(A{g}^{+})}$,由于Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl),则平衡时c(I-)<c (Br-)<c(Cl-),故C错误;
D.滴定相同浓度的NaCl,NaBr,NaI时,由于Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl),则平衡时,NaI溶液中的Ag+浓度更小,NaBr中的Ag+浓度次之,NaCl溶液中的Ag+浓度最大,由于p Ag+=-lgc(Ag+),Ag+浓度越小,pAg+越大,根据图象,则滴定曲线①、②、③分别表示NaI溶液、NaBr溶液、NaCl溶液,故D正确.
故选D.
点评 本题考查沉淀滴定知识,根据溶度积常数分析,同类型沉淀可直接根据Ksp判断其溶解性情况,不同类型的沉淀则需要定量计算,为高频考点,题目难度不大,是基础题.


科目:高中化学 来源: 题型:选择题
| A. |  表示不同温度下,水溶液中H+和OH-的浓度变化,温度a>b | |
| B. |  表示30%H2O2在60℃时分解率与pH关系,说明pH越大H2O2分解率越大 | |
| C. | 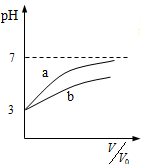 表示体积均为V0、pH均为3的盐酸和醋酸稀释时的pH变化,a表示盐酸 | |
| D. |  是等浓度NaCl和NaI溶液分别用AgNO3溶液滴定,则Ksp(AgI)>Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ/mol | |
| C. | 由石墨转化成金刚石需要吸收热量,则石墨比金刚石稳定 | |
| D. | lmol H2完全燃烧放热142.9kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=+285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池充电是使放电时的氧化还原反应的逆向进行 | |
| B. | 较长时间不使用电器时,最好从电器中取出电池,并妥善存放 | |
| C. | 氢氧燃料电池产物为无污染的水,属于环境友好电池 | |
| D. | 燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO和NaOH的混合溶液中通入少量的SO2:ClO-+H2O+SO2=C1-+SO42-+2H+ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,向盛有60mL pH=4HA溶液的绝热容器中加入pH=13的NaOH溶液,所得混合溶液的温度(T)与加入NaOH溶液体积(V)的关系如图所示.下列叙述不正确的是( )
25℃时,向盛有60mL pH=4HA溶液的绝热容器中加入pH=13的NaOH溶液,所得混合溶液的温度(T)与加入NaOH溶液体积(V)的关系如图所示.下列叙述不正确的是( )| A. | HA溶液的物质的量浓度为0.067mol•L-1 | |
| B. | 25℃时,HA的电离平衡常数约为1.5×10-9 | |
| C. | a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+) | |
| D. | b点时:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验室用乙醇制取乙烯 | B. |  实验室制取乙酸乙酯 | ||
| C. |  分离苯和甲苯 | D. |  实验室制取硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2ν(NO)逆=ν(CO2)正 | |
| B. | 混合气体的平均相对分子质量不再发生改变 | |
| C. | 恒温恒容条件下,反应体系的压强不再发生改变 | |
| D. | N2和CO2的体积分数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com