
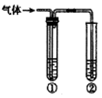
 用如图装置完成下列实验,不需要试管①的是(内盛有相应的除杂试剂)就能达到实验目的是
用如图装置完成下列实验,不需要试管①的是(内盛有相应的除杂试剂)就能达到实验目的是| 实验目的 | ②中的试剂 | |
| A | 检验碳与浓硫酸反应产生的气体中含有二氧化碳 | 澄清石灰水 |
| B | 用碳酸钙与盐酸反应产生的气体验证碳酸的酸性强于苯酚 | 苯酚钠溶液 |
| C | 验证乙醇在浓硫酸作用下发生消去反应产生的气体为不饱和烃 | 酸性高锰酸钾溶液 |
| D | 验证石蜡油在碎瓷片上受热分解产生的气体中含有不饱和烃 | 溴的四氯化碳溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.C与浓硫酸反应生成二氧化碳、二氧化硫,二者均与石灰水反应生成沉淀;
B.盐酸易挥发,盐酸与苯酚钠反应;
C.发生消去反应生成乙烯,且乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化;
D.石蜡油在碎瓷片上受热分解生成乙烯,乙烯与溴发生加成反应.
解答 解:A.C与浓硫酸反应生成二氧化碳、二氧化硫,二者均与石灰水反应生成沉淀,则需要试管①中试剂(如高锰酸钾)除去二氧化硫,故A不选;
B.盐酸易挥发,盐酸与苯酚钠反应,则需要试管①中试剂(如饱和碳酸氢钠)除去HCl,故B不选;
C.发生消去反应生成乙烯,且乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化,则需要试管①中试剂(如水)除去乙醇,故C不选;
D.石蜡油在碎瓷片上受热分解生成乙烯,乙烯与溴发生加成反应,则不需要试管①就能检验乙烯的生成,故D选;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,侧重考查学生的分析能力和实验能力,注意把握物质的性质以及实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 溶解度.Ksp均不变 | |
| B. | 溶解度.Ksp均变大 | |
| C. | 结晶过程停止,溶解过程加快 | |
| D. | 结晶过程将小于溶解过程,直至再达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验象 | 结论 |
| A | 将AlCl3溶液逐滴加NaOH溶液中 | 先无现象后产生白色胶状沉淀 | Al(OH)3是两性氢氧化物 |
| B | 向2支盛有醋酸和硼酸溶液的管中分别滴加Na2CO3溶液 | 醋酸:产生气泡; 硼酸:无现象 | Ka(CH3COOH)>Ka1(H2CO3)>Ka(H3BO3) |
| C | 将少量MgCl2溶液加入Fe(OH)3悬浊液中,振荡静置 | 沉淀由红褐色变为白色 | Fe(OH)3的溶解度大于Mg(OH)2 |
| D | 溴乙烷、乙醇及固体NaOH混合加热,产生的气态物质通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 溴乙烷发生消去反应生成了乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
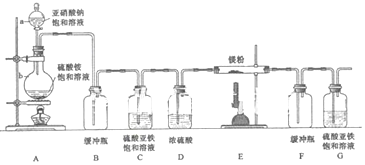
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y4X10分子中,极性键和非极性键的个数比为10:4 | |
| B. | Z和W形成的多种化合物中只有一种能与水反应 | |
| C. | 25℃时,等浓度的Z和Q的最高价氧化物对应水化物的水溶液中,水电离的c(H+)相等 | |
| D. | 25℃时,Z、W、X按原子个数比2:3:4形成的化合物的水溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质B的质量分数减小了 | ||
| C. | 物质A的转化率减少了 | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| N≡N | H-H | N-H | |
| 键能数据(KJ/mol) | 946 | 436 | x |

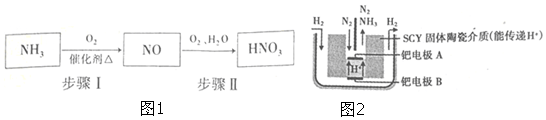
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子(S2-)的核外电子排布式:1s22s22p63s23p6 | |
| B. | N2的结构式::N≡N: | |
| C. | NaCl的电子式: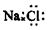 | |
| D. | CO2的分子模型示意图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com