
| A. | N2 | B. | Cl2 | C. | H2 | D. | CO2 |
分析 标况下,气体摩尔体积是22.4L/mol,根据V=$\frac{m}{M}$×Vm确定相同质量的不同气体体积大小.
解答 解:氮气的摩尔质量是28g/mol、氯气的摩尔质量是71g/mol、氢气的摩尔质量是2g/mol、二氧化碳的摩尔质量是44g/mol,标况下,气体摩尔体积是22.4L/mol,根据V=$\frac{m}{M}$×Vm知,相同质量的不同气体,其体积与摩尔质量成反比,摩尔质量最小的气体其体积最大,所以气体体积最大的是氢气,
故选C.
点评 本题考查了阿伏伽德罗定律及其推论,明确相同条件下,气体体积与其摩尔质量的关系是解本题关键,灵活运用公式来分析解答,题目难度不大.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:实验题
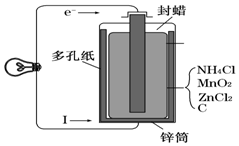 某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.
某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
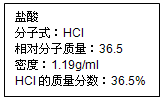 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | Ⅰ有气泡放出,澄清石灰水变浑浊 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入Ⅱ稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | Ⅲ猜想Ⅱ不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,Ⅳ滴入BaCl2溶液和稀HNO3溶液 | Ⅴ有白色沉淀且不溶于稀HNO3 | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.42mol•L-1 | B. | 0.21mol•L-1 | C. | 0.56mol•L-1 | D. | 0.24mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与S混合加热生成FeS2 | |
| B. | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| K1 | K2 | |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com