
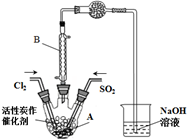
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如右表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如右表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生 剧烈水解 |
分析 (1)若用浓盐酸与二氧化锰为原料制取Cl2,浓盐酸与二氧化锰在加热条件下反应生成MnCl2、Cl2、H2O;
(2)磺酰氯(SO2Cl2)易水解,无水CaCl2,具有吸水作用,防止水蒸气进入三颈烧瓶;
(3)正反应为放热反应,降低温度有利于SO2Cl2的生成,控制温度使SO2Cl2为液态,与未反应是氯气、二氧化硫分离;
(4)如果Cl2或SO2含有水蒸气,氯气和二氧化硫、水反应生成HCl与硫酸;
(5)①SO2Cl2遇水发生剧烈水解,且产生白雾,白雾是水解生成HCl与空气中水蒸气结合所致,则-SO2-基团结合2个-OH生成H2SO4;
②无色溶液W为HCl、H2SO4混合溶液,除含少量OH-外,还含有Cl-、SO42-,先用Ba(NO3)2溶液检验SO42-,过滤后,滴加HNO3酸化,再加入AgNO3溶液检验有Cl-;
③W溶液中得到白色沉淀,是SO2Cl2水解生成H2SO4与BaCl2溶液反应生成的BaSO4,烧杯中白色沉淀是未反应的二氧化硫转化为硫酸钠,硫酸钠与BaCl2溶液反应生成的BaSO4,根据S元素守恒计算参加反应的二氧化硫物质的量、通入的二氧化硫总物质的量,进而计算SO2的转化率.
解答 解:(1)浓盐酸与二氧化锰反应生成二氯化锰和氯气和水,方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)磺酰氯(SO2Cl2)易水解,防止烧杯中的水蒸气进入三颈烧瓶引起SO2Cl2水解,C仪器装的药品是无水CaCl2吸水干燥,
故答案为:防止水蒸气进入A装置(引起SO2Cl2水解);
(3)正反应为放热反应,降低温度有利于SO2Cl2的生成,控制温度使SO2Cl2为液态,与未反应是氯气、二氧化硫分离,故选择冷水浴,
故答案为:a;
(4)如果Cl2或SO2含有水蒸气,氯气和二氧化硫、水反应生成HCl与硫酸,反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(5)①SO2Cl2遇水发生剧烈水解,且产生白雾,白雾是水解生成HCl与空气中水蒸气结合所致,则-SO2-基团结合2个-OH生成H2SO4,反应方程式为:SO2Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
②无色溶液W为HCl、H2SO4混合溶液,除含少量OH-外,还含有Cl-、SO42-,检验二者的方法为:取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-,
故答案为:取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-;
③W溶液中得到白色沉淀,是SO2Cl2水解生成H2SO4与BaCl2溶液反应生成的BaSO4,其物质的量为$\frac{X}{233}$mol,根据S元素守恒,参加反应的二氧化硫物质的量为$\frac{X}{233}$mol,烧杯中白色沉淀是未反应的二氧化硫转化为硫酸钠,硫酸钠与BaCl2溶液反应生成的BaSO4,其物质的量为$\frac{Y}{233}$mol,故通入的二氧化硫总物质的量为($\frac{X}{233}$+$\frac{Y}{233}$)mol,
则SO2的转化率为为[$\frac{Y}{233}$mol÷($\frac{X}{233}$+$\frac{Y}{233}$)mol]×100%=$\frac{X}{X+Y}$×100%,
故答案为:$\frac{X}{X+Y}$×100%.
点评 本题考查制备实验方案,涉及化学方程式书写、对装置与操作的分析评价、离子检验、化学计算等,明确原理是解题关键,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 聚乙炔是乙炔发生聚合反应形成的高聚物 | |
| B. | 聚乙炔的化学式为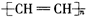 | |
| C. | 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质 | |
| D. | 等质量的聚乙炔和乙烯分别完全燃烧时,它们耗氧量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的导电性能相同 | |
| B. | 与足量的锌粉反应的起始速率相同 | |
| C. | 与足量的锌粉反应产生氢气的体积比为1:2:100 | |
| D. | 与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1:1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2吸收溴单质时发生反应的化学方程式为:2H2O+SO2+Br2═H2SO3+2HBr | |
| B. | 海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2═Br2+2Cl- | |
| C. | Cl-的结构示意图为: | |
| D. | 海水中Br-的电子式为: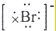 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水的电离度α(25℃)>α(100℃) | |
| B. | 水电离时其热效应是△H>0的过程 | |
| C. | 纯水中的c(H+)随着温度的降低而增大 | |
| D. | 在100℃时,纯水依然呈中性,则c(H+)=c(OH-)=1.0×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com