

图1-3-24
请填写以下空白:
(1)B的电子式__________,D分子的空间构型__________。
(2)写出反应①、②的化学反应方程式:
①___________________________________________________;
②__________________________________________________。
(3)写出反应③的离子方程式:___________________________________________________。
解析:此题的难点是A和G的确定。以A加热分解得到相等物质的量的B、C、D为突破口,联想到中学阶段符合此要求的常见反应有如下几个:2NaHCO3![]() Na2CO3+CO2↑+H2O,NH4HCO3
Na2CO3+CO2↑+H2O,NH4HCO3![]() NH3↑+CO2↑+H2O,NH4HSO3
NH3↑+CO2↑+H2O,NH4HSO3![]() NH3↑+SO2↑+H2O;再根据图中信息,B能在镁条中燃烧确定B为CO2初步得出A为NaHCO3或NH4HCO3,排除NH4HSO3;又因为C+Na2O2
NH3↑+SO2↑+H2O;再根据图中信息,B能在镁条中燃烧确定B为CO2初步得出A为NaHCO3或NH4HCO3,排除NH4HSO3;又因为C+Na2O2![]() G,能与Na2O2反应的只能为水,从而推出C为H2O,D为Na2CO3或NH3,G为O2或NaOH;再根据图中信息D和G在催化剂、加热的条件下生成H,排除G为NaOH的可能,得出G为O2,D为NH3;从而可依次得出,H为NO,I为NO2,J为HNO3;F为C,E为MgO。
G,能与Na2O2反应的只能为水,从而推出C为H2O,D为Na2CO3或NH3,G为O2或NaOH;再根据图中信息D和G在催化剂、加热的条件下生成H,排除G为NaOH的可能,得出G为O2,D为NH3;从而可依次得出,H为NO,I为NO2,J为HNO3;F为C,E为MgO。
答案:(1) ![]() 三角锥形
三角锥形
(2)①2Mg+CO2![]() 2MgO+C
2MgO+C
②4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(3) ![]() +
+![]() +2 OH-====NH3↑+
+2 OH-====NH3↑+![]() +2H2O
+2H2O


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图2 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
| 508000b |
| a |
| 508000b |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
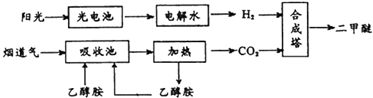
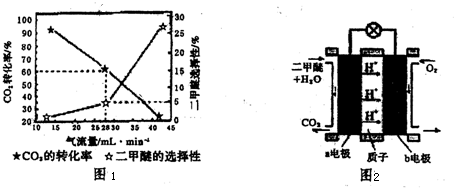
查看答案和解析>>
科目:高中化学 来源: 题型:

图1-4-23
加热聚丙烯废塑料得到的产物如下表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
(1)试管A中残余物有多种用途,如图1-4-24转化就可制取高聚物聚乙炔。
A中残留物①电石②乙炔③聚乙炔
![]()
图1-4-24
写出反应②③的化学方程式______________________、______________________。
(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质,其一氯代物有______种。
(3)锥形瓶C中观察到的现象_________________________________。经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为___________。
(4)写出C中逸出的气体在工业上的两种用途___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:

图1-5-22
(1)在实验室中,收集气体C可选择如图图1-5-23甲装置中的_______ (填选项字母)。

图甲 图乙
图1-5-23
(2)操作②的名称是_______,在操作②中所使用的玻璃仪器的名称是_______。在得到固体D时必须进行洗涤、干燥等操作,洗涤固体D的操作方法是____________________________。
(3)写出下列反应的化学方程式或离子方程式:
反应①______________;反应③______________;反应④______________。
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过如上面图乙所示的装置,其中瓶Ⅰ中盛放的是_______,瓶Ⅱ中盛放的是_______。
(5)实验中多余的气体F必须吸收,以免污染空气。图1-5-24是实验室用NaOH吸收气体F的装置,为防止产生倒吸现象,合理的装置是_______ (填序号)。

图1-5-24
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com