
| A.a点 | B.b点 | C.c点 | D.d点 |

科目:高中化学 来源:不详 题型:单选题
| A.反应容器中压强不随时间变化而变化 |
| B.混合气体颜色保持不变 |
| C.混合气体的密度保持不变 |
| D.各物质的物质的量浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容器内气体的平均摩尔质量不随时间变化而改变 |
| B.容器内气体密度不随时间变化而改变 |
| C.容器内压强不随时间变化而改变 |
| D.单位时间内每生成0.5molB的同时生成0.25molD |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
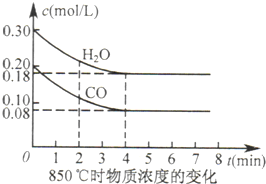
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.前10min内用v(NO2)表示的化学反应速率为0.06mol/(L?min) |
| B.图中的两条曲线,X是表示NO2浓度随时间的变化曲线 |
| C.a、b、c、d四个点中,只有b、d点的化学反应处于平衡状态 |
| D.25min时,导致平衡移动的原因是将密闭容器的体积缩小为1L |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
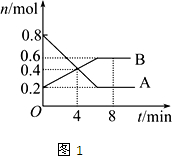
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
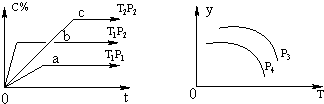
| A.p3>p4,y轴表示A的转化率 |
| B.p3<p4,y轴表示混合气体的密度 |
| C.p3<p4,y轴表示B的质量分数 |
| D.p3<p4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a+b<c,Q>0 | B.a+b<c,Q<0 | C.a+b>c,Q>0 | D.a+b>c,Q<0 |
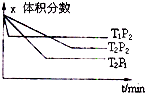
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com