
| A. | 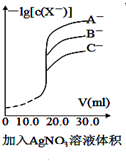 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图可确定首先沉淀的是C- | |
| B. | 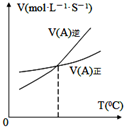 图表示反应中某反应物的正、逆反应速率随温度变化情况,由图可知该反应的正反应是吸热反应 | |
| C. | 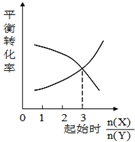 一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3Y?Z | |
| D. | 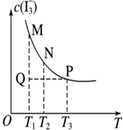 图表示溶液中反应:I2+I-?I3- 平衡c(I3-)随温度变化,反应速度V(正)M<V(逆)N |
分析 A.-lg越大,则c(X-)越小,越先生成沉淀;
B.当正逆反应速率相等时,反应到平衡,但随着温度升高,逆反应速率大于正反应速率;
C.当反应物的起始物质的量比等于化学计量数比是,物质的转化率相同;
D.从图分析,随温度升高,c(I3-)逐渐减小,说明反应逆向移动.
解答 解:A.从图象分析可知,-lg越大,则c(X-)越小,越先生成沉淀,则首先生成沉淀是A-,故A错误;
B.当正逆反应速率相等时,反应到平衡,但随着温度升高,逆反应速率大于正反应速率,则反应向逆向移动,说明正反应为放热反应,故B错误;
C.当反应物的起始物质的量比等于化学计量数比是,物质的转化率相同,从图分析,当X的物质的量与Y 的物质的量比为3时,转化率相同,则二者化学计量数比为3:1,则方程式为3X+Y Z,故C错误;
Z,故C错误;
D.从图分析,随温度升高,c(I3-)逐渐减小,说明反应逆向移动,则逆反应速率大于正反应速率,故D正确.
故选D.
点评 本题考查难溶电解质的溶解平衡及沉淀转化、化学平衡的移动等知识,把握反应原理为解答的关键,注意从实验的评价性及物质性质分析解答,题目难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题
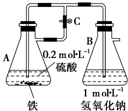 当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表而镀铜可以增强其抗腐蚀性 | |
| B. | 用高温催化氧化法去除烃类废气(CxHy):CxHy+(x+$\frac{y}{4}$)O2$→_{高温}^{催化剂}$xCO2+$\frac{y}{2}$H2O | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 废旧电池中含有的重金属离子对水和土壤会造成污染,因而不能随意丢弃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砖块中的主要成分是硅酸盐 | |
| B. | 青砖中的铁元素主要以氢氧化亚铁的形式存在 | |
| C. | 红砖中的铁元素主要以氧化铁的形式存在 | |
| D. | 青砖中的铁元素主要以氧化亚铁的形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g 18O2中含有的氧原子数是2×6.02×1023 | |
| B. | 1 mol N2和CO的混合气体中含有的分子总数是2×6.02×1023 | |
| C. | 2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023 | |
| D. | 1.0 L 0.1 mol•L-1 NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体 | |
| B. | 淀粉、蛋白质、脂肪都是营养物质,都属于高分子化合物 | |
| C. | 在蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不溶解 | |
| D. | 北京奥运吉祥物“福娃”的材质是PVC(聚氯乙烯),其单体的结构是CH2=CHCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2n+3-m | B. | a+2-m | C. | n+m+a | D. | a+2n+2-m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
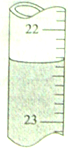 准确移取25.00mL某未知浓度的NaOH溶液于一洁净锥形瓶中,然后用0.20mol/L的盐酸溶液滴定(指示剂为甲基橙),滴定结果如下:
准确移取25.00mL某未知浓度的NaOH溶液于一洁净锥形瓶中,然后用0.20mol/L的盐酸溶液滴定(指示剂为甲基橙),滴定结果如下:| HCl溶液起始读数 | HCl溶液终点读数 | |
| 第一次 | 2.15mL | |
| 第二次 | 3.10mL | 21.85mL |
| 第三次 | 4.20mL | 22.95mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合后的溶液 | 加入的酸 | 酸的浓度/(mol•L-1) | 混合后溶液的pH |
| ① | HA | 0.10 | 8.7 |
| ② | HB | 0.12 | 2 |
| A. | HA是强酸,HB是弱酸 | |
| B. | 升高温度,溶液②中$\frac{c({B}^{-})}{c(N{a}^{+})}$增大 | |
| C. | 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com