
| V2O5 |
| 500℃ |
| A、容器中SO2、O2、SO3共存 |
| B、SO2 与SO3的浓度相等 |
| C、反应容器中压强不随时间变化 |
| D、容器中SO2、O2、SO3的物质的量之比为2:1:2 |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
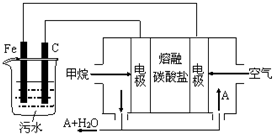 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合气体的平均相对分子质量为30 |
| B、原混合气体的平均相对分子质量为28 |
| C、起始时,NH3与CO2的体积比为13:14 |
| D、起始时,NH3与CO2的体积比为14:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②④⑤ |
| C、②③⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的物质的量不再变化 |
| B、单位时间内消耗amolA,同时生成3amolC |
| C、容器内的压强不再变化 |
| D、容器内气体颜色不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com