
| A. | Cu | B. | C | C. | Na2CO3 | D. | SiO2 |
分析 A、铜与浓硫酸在加热的条件下生成硫酸铜和二氧化硫;
B、碳与浓硫酸反应生成二氧化碳和二氧化硫;
C、碳酸钠与硫酸反应生成硫酸钠和二氧化碳气体;
D、二氧化硅是酸性氧化物与浓硫酸不反应.
解答 解:A、铜与浓硫酸在加热的条件下生成硫酸铜和二氧化硫,能反应,不符合条件,故A不选;
B、碳与浓硫酸反应生成二氧化碳和二氧化硫,能反应,不符合条件,故B不选;
C、碳酸钠与硫酸反应生成硫酸钠和二氧化碳气体,能反应,不符合条件,故C不选;
D、二氧化硅是酸性氧化物与浓硫酸不反应,不能反应,符合条件,故D选;
故选D.
点评 本题考查浓硫酸的化学性质,浓硫酸具有极强的氧化性,能与大多数金属和非金属反应的强酸,比较容易.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 预期现象 | 离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2↑+H2O |
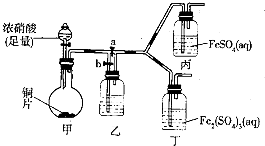
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 高温或日常用的消毒剂可使禽流感病毒蛋白质变性 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
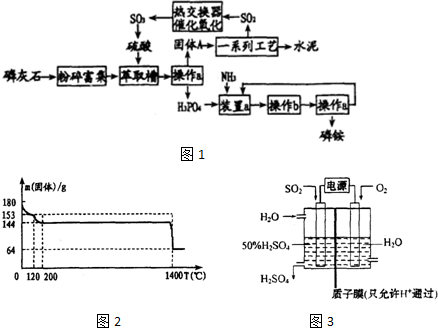
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠可用作木材防火涂料 | B. | Fe2O3可用作外墙涂料 | ||
| C. | 过氧化钠可用作潜艇供氧剂 | D. | 铝制容器可以贮运稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
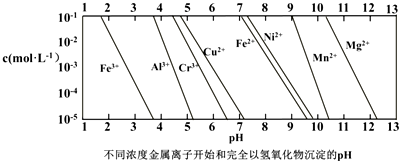
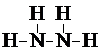 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
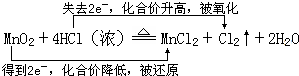
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com