
有关物质用途,用离子方程式解释不正确的是
A. 氢氟酸刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O
B. 明矾用于净水:Al3++3H2O=Al(OH)3↓+3H+
C. 纯碱去除油污:CO32-+H2O HCO3-+OH-
HCO3-+OH-
D. 氯气制备“84”消毒液:Cl2+2OH-=Cl-+ClO-+H2O
科目:高中化学 来源:2016届甘肃省天水市高三上学期期中测试化学试卷(解析版) 题型:选择题
各组性质比较的表示中,正确的是
A.沸点:Cl2<F2<Br2<I2 B.沸点:HF<HCl<HBr<HI
C.氧化性:F2 <Cl2<Br2<I2 D.还原性:HF<HCl<HBr<HI
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省台州市高二上学期第一次月考化学试卷(解析版) 题型:选择题
已知充分燃烧乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-2b kJ·mol?1
B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l); ΔH=2b kJ·mol?1
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-4b kJ·mol?1
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=b kJ·mol?1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第二次月考化学试卷(解析版) 题型:选择题
下列有关AgCl沉淀的溶解平衡的说法中,正确的是
A.升高温度,AgCl的溶解度减小
B.在任何含AgCl固体的水溶液中,c(Ag+)=c(Cl-)且二者乘积是一个常数
C.AgCl沉淀生成和溶解不断进行,但速率相等
D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解的质量不变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C.生成nmolCO的同时生成nmolH2
D.1molH—H键断裂的同时断裂2molH—O键
查看答案和解析>>
科目:高中化学 来源:2016届宁夏大学附属中学高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
在下列给定条件的溶液中,一定能大量共存的粒子组是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
B.常温下,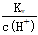 =0.001 mol·L-1的溶液:Na+、K+、SiO32-、NO3-
=0.001 mol·L-1的溶液:Na+、K+、SiO32-、NO3-
C.水电离的c(H+)水=1.0×10 -13mol·L-1溶液中:AlO2-、K+、SO42-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、NH4+、NO3-
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期第二次模拟理综化学试卷(解析版) 题型:选择题
下列实验能达到预期目的的
选项 | 实验内容 | 实验目的 |
A | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大。 | 证明了非金属性S>C |
B | 某溶液中加入少量双氧水,再加几滴KSCN溶液后变红 | 可以证明原溶液中一定含Fe2+ |
C | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅。 | 可以证明Na2CO3溶液中存在水解平衡。 |
D | 取两只试管,分别加入4ml 0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/L H2C2O4溶液2ml,向另一只试管中加入0.1mol/L H2C2O4溶液4ml,记录褪色时间。 | 可以证明H2C2O4浓度越大反应速率越快。 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省宁德市高一上学期期中测试化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的数值,下列说法中正确的是
A.常温常压下,32g氧气所含的原子数为NA
B.标准状况下,22.4L 水的分子数为NA
C.0℃,101KPa下,44.8L氮气所含有的分子数为2NA
D.常温常压下,1mol二氧化碳气体含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江台州中学高二上第三次统练化学试卷(解析版) 题型:简答题
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:

(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)45 min时刻改变的条件是 。
(4)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率从大到小的排列次序为 (平均反应速率分别以v1、v2、v3表示)。
(5)随着条件的改变,达到三次平衡时H2的转化率也发生[了变化,如分别以α1、α2、α3表示,其中最小的是 。
(6)请在图中用实线表示25~45、45~60min 两阶段化学平衡常数K的变化图像。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com