
正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
B.SiH4、PH3、HCl的稳定性逐渐增强
C.过氧乙酸(CH3COOO H)与羟基乙酸(HOCH2COOH)所含官能团相同;两者互为同分异 构体
H)与羟基乙酸(HOCH2COOH)所含官能团相同;两者互为同分异 构体
D.Ca2+的结构示意图为,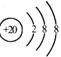 NH4Cl的电子式为
NH4Cl的电子式为
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
体积相同,pH相同的 ①稀盐酸 ②稀硫酸 ③稀醋酸,分别用同物质的量浓度的NaOH溶液完全中和时,所消耗的NaOH溶液的体积关系正确的是 ( )
A.②=①>③ B.②>①>③ C.②<①=③ D.③>②=①
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,以下化学用语或表述正确的是 ( )
A.乙烯的结构简式:CH2CH2
B.碳正离子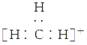 中质子数与电子数的比值为3∶2
中质子数与电子数的比值为3∶2
C.聚丙烯的结构简式为
D.NaHCO3水解反应的离子方程式:HCO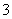 +H2O
+H2O H3O++CO
H3O++CO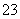
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,错误的是( )
A.明矾水解的离子方程式:Al3++3H2O  Al(OH)3+3H+
Al(OH)3+3H+
B.CaCO3(s)=CaO(s)+CO2(g) △S>0
C.用纯碱溶液洗涤餐 具的原因,用离子方程式表示:CO32-+2H2O
具的原因,用离子方程式表示:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
D.BaSO4悬浊液中存在平衡:BaSO4(s)  Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是
A.S原子的结构示意图: B.氯化钠的电子式:
B.氯化钠的电子式: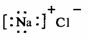
C.纯碱的化学式:Na2CO3 D.碳酸钠的电离方程式:NaHCO3=Na+ + H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨的流程示意图如下:

回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是________、________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学方程式_______________________。
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是________,其中发生的化学反应方程式为____________。
(3)设备B的名称为________,其中m和n是两个通水口,入水口是________(填“m”或“n”)。不宜从相反方向通水的原因是______________。
(4)设备C的作用是______________________。
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
已知1 000 K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
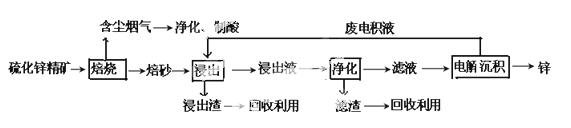
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是____。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为___________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤 炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即
炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即 倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉
倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉 甘石的主要成分为碳酸锌,倭铅是指金属锌)
甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是宝贵的自然资源,从海水中可以提取多种化工原料,如图是某工厂对海水综合利用的示意图:
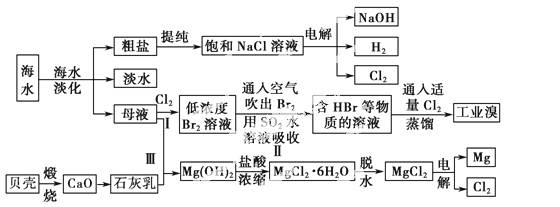
(1)在粗盐中含有Ca2+、Mg2+、SO等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。则加入试剂的先后顺序是____________(填编号)。
(2)工业上电解饱和食盐水的离子方程式:_________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是____________ _____。
_____。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式:_____________________。
(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入________溶液,充分搅拌后经________(填操作方法)可得纯 净的Mg(OH)2。
净的Mg(OH)2。
(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2·6H2O的原因:______________________。
(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是________(填序号)。
A.H2 B.CO2 C.空气 D.O2 E.水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。A原子L层的成对电子数和未成对电子数相等,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是 (用对应的元素符号表示);基态D原子的电子排布式为 。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取 杂化;B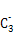 的空间构型为 (用文字描述)。
的空间构型为 (用文字描述)。
(3)1 mol AB-中含有的π键个数为 。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是 。
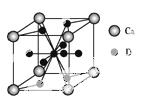
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10- 23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n= (填数值);氢在合金中的密度为 。
23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n= (填数值);氢在合金中的密度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com