
【题目】钨是熔点最高的金属,是重要的战略物资,广泛用于钢铁工业,电真空照明材料等方面。黑钨矿是一种有开采价值的钨矿石,其主要成分是铁和锰的钨酸盐(常用FeWO4、MnWO4表示)。它的传统冶炼工艺的第一阶段如下图所示:

注:①上述流程中钨的化合价不变 ②钨酸(H2WO4)是一种难溶性酸
(1)写出C的化学式:______;写出生成B的化学方程式:_________
(2)上述流程中,第一次过滤所得滤渣的主要成份除MnO2外,还含有_________,请写出FeWO4在熔融条件下发生反应生成该成分的化学方程式_________
(3)冶炼金属钨是用非整比的钨氧化物为原料,钨元素在其中存在两种价态:+5价和+6价,试确定组成为WO2.7的氧化钨中两种对应价态的钨原子个数的整数比为_____________。
(4)黑钨矿还含少量Si、As的化合物,上述流程需优化(见下图)。向含Na2WO4的滤液中加硫酸调节pH=10后,再除杂净化。

则“净化”过程中,加入H2O2的目的是__________,滤渣Ⅰ的主要成分是____________。
(5)某温度下,Ca(OH)2、CaWO4的相关数据见下表
项目 | CaWO4 | Ca(OH)2 |
-lgc(阴离子) | 4 | 2 |
-lgc(Ca2+) | 6 | 4 |
将钨酸钠溶液加入石灰乳中,发生反应的离子方程式为WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
【答案】 WO3 Na2WO4+2HCl=H2WO4↓+2NaCl Fe2O3 4FeWO4+ O2+ 8NaOH =2Fe2O3↓+4Na2WO4 + 4H2O 3 : 2 (或2 : 3 ) 将含砷化合物氧化以便更好地除去杂质(其它合理解释也可) MgSiO3 MgHAsO4 100
【解析】熔融FeWO4、MnWO4和氢氧化钠在氧气的作用下,反应生成Fe2O3、MnO2和钨酸钠,MnO2和Fe2O3均不溶于水,钨酸钠易溶于水,经过水浸、过滤,滤液为钨酸钠溶液;钨酸钠和浓盐酸反应生成钨酸(B)和氯化钠,化学方程式为:Na2WO4 +2HCl═H2WO4↓+2NaCl;钨酸高温生成氧化钨(C),氢气还原氧化钨生成钨和水,化学方程式为:WO3 +3H2![]() W+3H2O;
W+3H2O;
(1)由分析可知C的化学式为WO3 ;生成B的化学方程式为Na2WO4+2HCl=H2WO4↓+2NaCl;
(2)上述流程中,第一次过滤所得滤渣的主要成份除MnO2外,还含有Fe2O3,FeWO4在熔融条件下与NaOH、O2发生反应生成Fe2O3的化学方程式为4FeWO4+ O2+ 8NaOH =2Fe2O3↓+4Na2WO4 + 4H2O;
(3)这种氧化钨中存在五价和六价两种价态的钨,设钨的平均价态为x,则x+(-2)×2.8=0,解得x=+5.6,化合物中正负化合价代数和为零,设每个WO2.8的分子中五价的原子个数为a,六价的原子个数为b,则有5a+6b=5.6和a+b=1解之得,b=0.4,a=0.6,可知这两种价态的钨原子数之比为0.6:0.4=3:2;
(4)H2O2有强氧化性,“净化”过程中,加入H2O2的目的是 将含砷化合物氧化以便更好地除去杂质,滤渣Ⅰ的主要成分是Mg2+与溶液中的SiO32-和HAsO42-生成的不溶物MgSiO3和MgHAsO4 ;
(5)已知CaWO4(s)![]() WO42-(aq)+Ca2+(aq),ksp(CaWO4)=c(WO42-)×c(Ca2+)=1×10-6×1×10-4=1×10-10;Ca(OH)2(s)
WO42-(aq)+Ca2+(aq),ksp(CaWO4)=c(WO42-)×c(Ca2+)=1×10-6×1×10-4=1×10-10;Ca(OH)2(s)![]() 2OH-(aq)+Ca2+(aq),ksp(Ca(OH)2)=c2(OH-)×c(Ca2+)=(1×10-2)2×1×10-4=1×10-8;则WO42-(aq)+Ca(OH)2(s)
2OH-(aq)+Ca2+(aq),ksp(Ca(OH)2)=c2(OH-)×c(Ca2+)=(1×10-2)2×1×10-4=1×10-8;则WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数=ksp(Ca(OH)2)÷ksp(CaWO4)=(1×10-8)÷(1×10-10)=100。
CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数=ksp(Ca(OH)2)÷ksp(CaWO4)=(1×10-8)÷(1×10-10)=100。


科目:高中化学 来源: 题型:
【题目】如图,a、b、d均为石墨电极,c为Mg电极,通电进行电解(电解液足量),下列说法正确的是
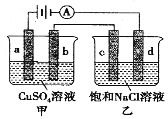
A.向甲中加入适量Cu(OH)2,溶液组成可以恢复
B.电解一段时间,乙溶液中会产生白色沉淀
C.当b极增重3.2g时,d极产生的气体体积为1.12L
D.甲中b极上的电极反应式为:4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是一种行之有效、简单易行的科学方法。下列有关物质分类或归类正确的是()
A. 混合物:漂白粉、王水、Fe(OH)3胶体、冰水混合物
B. 硅酸盐:光导纤维、水晶、玻璃、水泥。
C. 电解质:胆矾、硫酸钡、冰醋酸、氧化钾
D. 同素异形体:C60、碳纳米管、金刚石、石墨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,下列各组离子在指定溶液中能大量共存的是( )
A. pH=1的溶液中: I-、NO3-、SO42-、Na+
B. 由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C. c(H+)/c(OH-)=1012的溶液中: NH4+、Al3+、NO3-、Cl-
D. c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做( )
A. 阴极 B. 阳极 C. 正极 D. 负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C6H14O的醇有多种结构,其中能经过两步氧化生成羧酸的结构有(不考虑立体异构)( )
A. 8种 B. 9种 C. 10种 D. 11种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A.丁达尔效应可用于鉴别胶体和溶液
B.胶体粒子的直径在1~100 nm之间
C.胶体一定是混合物
D.将FeCl3稀溶液溶于冷水即可制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、科技、医药、工业生产均密切相关,下列有关化学叙述正确的是( )
A. 浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品
B. 我国预计2020年发射首颗火星探测器太阳能电池帆板的材料是二氧化硅
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
D. 误食重金属盐引起的人体中毒,可喝大量的食盐水解毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为:
(2)已知燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-= CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
(3)随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
(4)通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com