
| A. | 10 g H218O中所含的中子数为5NA | |
| B. | 1 mol 铁单质与足量的硫单质充分反应,电子转移数目为3NA | |
| C. | 在1 L 0.1mol/L的NH4Cl溶液中,阴、阳离子总数小于0.2NA | |
| D. | 一定条件下,将1mol N2和3mol H2充分反应,产物分子数目小于2NA |
分析 A.质量转化为物质的量,结合1个 H218O含有10个中子解答;
B.铁与硫反应生成硫化亚铁;
C.NH4Cl溶液中,氯化铵、水都是电解质,都能电离生成离子;
D.氮气与氢气反应生成氨气为可逆反应.
解答 解:A.10 g H218O物质的量为$\frac{10g}{20g/mol}$=0.5mol,含有中子的物质的量=0.5mol×10=5mol,个数为5NA,故A正确;
B.1 mol 铁单质与足量的硫单质充分反应生成1molFeS,电子转移数目为2NA,故B错误;
C.在1 L 0.1mol/L的NH4Cl溶液中,阴、阳离子总数大于0.2NA,故C错误;
D.氮气与氢气反应生成氨气为可逆反应,可逆反应不能进行到底,所以一定条件下,将1mol N2和3mol H2充分反应,产物分子数目小于2NA,故D正确;
故选:AD.
点评 本题考查物质的量的有关计算,为高频考点,侧重考查学生判断及计算能力,明确该分子构成是解本题关键,注意可逆反应特点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若pH>7时,则一定是c1V1=c2V2 | |
| B. | 只有当pH<7时,才能满足c(R+)+c(H+)=c(A-)+c(OH-) | |
| C. | 当pH=7时,若V1=V2,则一定是c1<c2 | |
| D. | 若V1=V2、c1=c2,则c(A-)+c(HA)=c(R+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
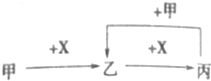
| A. | 甲为CO2,X为NaOH溶液 | B. | 甲为NH3,X为O2 | ||
| C. | 甲为Si,X为O2 | D. | 甲为NaAlO2,X为HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
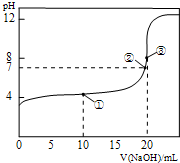 25℃时,用 0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LCH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )
25℃时,用 0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LCH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )| A. | 点①所示溶液:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| B. | 点②所示溶液:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| C. | 点③所示溶液:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定终点时:c(CH3COOH)+c(CH3COO-)=c(Na+ ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
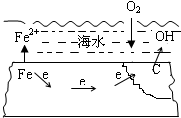
| A. | 该腐蚀过程为析氢腐蚀 | |
| B. | 正极的反应为:O2+2H2O+4e→4OH- | |
| C. | 碳上发生的是氧化反应 | |
| D. | 若该钢铁上焊有铜钉,其被腐蚀的速率将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
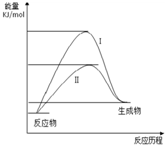 某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )
某化工生产反应历程的能量变化如图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )| A. | 反应物的状态 | B. | 反应的完成程度 | C. | 生产能耗 | D. | 反应热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
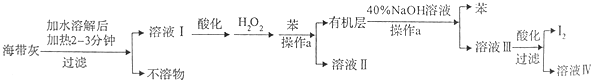
| 编号 | 1 | 2 | 3 |
| 溶液的体积/ml | 10.00 | 10.00 | 10.00 |
| 消耗Na2S2O3标准溶液的体积/ml | 19.95 | 17.10 | 20.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com