
| A. | 易形成-1价离子 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下单质的氧化性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
分析 A、ⅦA族元素最高正价为+7价,最低负价=最高正价-8;
B、ⅦA族元素从上到下电子层在增多,据此确定原子半径大小;
C、ⅦA族元素从上到下得电子的能力减弱,单质的氧化性逐渐减弱;
D、ⅦA族元素从上到下非金属性减弱,氢化物的稳定性逐渐减弱.
解答 解:A、因ⅦA族元素最高正价为+7价,则最低价为7-8=-1价,即易形成-1价离子,故A不选;
B、ⅦA族元素从上到下电子层数增多,则原子半径增大,故B选;
C、ⅦA族元素从上到下得电子的能力减弱,则非金属性逐渐减弱,故C不选;
D、ⅦA族元素从上到下非金属性减弱,则对应的氢化物的稳定性依次减弱,故D不选;
故选B.
点评 本题考查ⅦA族元素性质,熟悉原子结构及元素周期表、元素周期律即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 电解质与非电解质的本质区别,是在水溶液中或熔融状态下能否电离 | |
| B. | 在水溶液中和熔融状态下都能导电的化合物叫电解质 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都是非电解质 | |
| D. | 常见的强酸、强碱和大部分盐都是电解质,其他化合物都是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8倍 | B. | 12倍 | C. | 24倍 | D. | 64倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
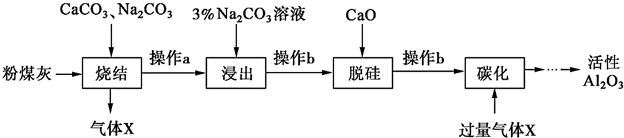
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
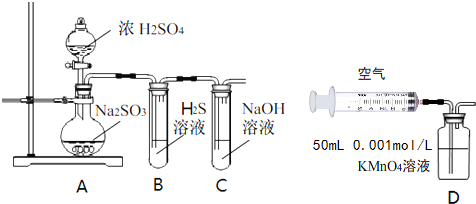
| 实验步骤 | 实验操作 | 预期现象与结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
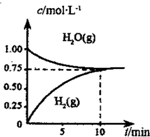 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 达平衡时,CH4(g)的转化率为75% | |
| B. | 0~10min内,v(CO)=0.075mol•L-1•min-1 | |
| C. | 该反应的化学平衡常数K=O.1875 | |
| D. | 当CH4(g)的消耗速率与H2(g)的消耗速率相等时,反应到达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:6:7 | B. | 1:1:1 | C. | 4:8:5 | D. | 8:4:7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com