
【题目】当三份铜粉分别与足量的稀硝酸、浓硝酸、热的浓硫酸反应后收集到的气体在相同状况下体积相等时,三份铜粉的质量比为
A. 3:1:2 B. 3:2:2 C. 1:1:2 D. 1:3:2
【答案】A
【解析】当三份铜粉分别与足量的稀硝酸、浓硝酸、热的浓硫酸反应后收集到的气体在相同状况下体积相等时,我们假设所有的气体在标况下都是22.4L,即均是1mol,则
(1)当铜粉与足量的稀硝酸反应,生成1molNO时
3Cu+8HNO3=3 Cu(NO3)2+2NO↑+4H2O
3 2
1.5 1 mol
(2)当铜粉与足量的浓硝酸反应,生成1molNO2时
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
1 2
0.5 1 mol
(3)当铜粉与热的浓硫酸反应,生成1molSO2时
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
1 1
1 1 mol
三份铜粉的质量比为1.5:0.5:1=3:1:2,答案选A。


科目:高中化学 来源: 题型:
【题目】东汉《周易参同契》中记载:“胡粉投火中,色坏还为铅”,实验表明胡粉难溶于水,加强热产生能使澄清的石灰水浑浊的湿气.胡粉的主要成分
A. PbCO3 B. SnCO3Sn(OH)2 C. 2PbCO3Pb(OH)2 D. (CH3COO)2Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】借助碱金属和卤族元素的递变性分析下面的推断,其中正确的是( )
A.已知Ca是第4周期、第ⅡA族的元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱
B.已知As是第4周期、第ⅤA族的元素,故AsH3的稳定性比NH3的稳定性强
C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈
D.已知Cl的核电荷数比F的核电荷数大,故Cl的原子半径比F的原子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中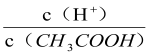 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不![]() 变
变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室模拟工业上以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
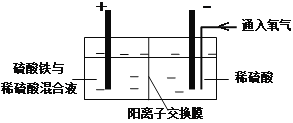
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)![]() R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
① 阳极区硫酸铁的主要作用是 _____________。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是_____________。(使用化学用语作答)
(2)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 _____________;加入有机萃取剂的目的是___________________。
(3)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 _____________。
(4)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ___________________。(忽略电解前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO的一种制备流程图如下:
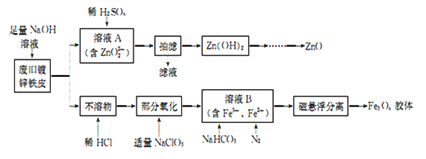
(1)用NaOH溶液处理废旧锌铁皮发生反应的化学方程式为____________。
(2)①若溶液A中滴加稀H2SO4过量,会溶解产生的Zn(OH)2,可改用的方法是____________。
②由Zn(OH)2灼烧制ZnO前需进行洗涤,检验沉淀洗涤是否干净的方法是______________。
(3)流程中加人NaC1O3发生反应的离子方程式为______________。
(4)①由溶液B制得Fe3O4胶体粒子的过程中通入N2的原因是____________。
②溶液B中主要发生的离子反应方程式为________________。
③确定溶液B中含有Fe2+的实验方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知可逆反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O,设计如下图装置,进行下述操作:
AsO33-+I2+H2O,设计如下图装置,进行下述操作:
①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反。回答下列问题

(1)操作①过程中,C1棒为__________极,C2棒上发生的反应为______________________
(2)操作②过程中盐桥中的_________离子移向(I)烧杯,C1棒上发生的反应为_____________
(3)若将微安表换成电解冶炼铝装置,写出电解总反应方程式__________________________________
(4)若将微安表换成电解精炼铜装置,在操作②过程中与C2棒连接的为_________电极,电解一段时间后,溶液中CuSO4溶液的浓度_____________(填“变大”“变小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A的产量是衡量一个国家石油化工发展水平的标志,D是食醋中的主要成分。A能发生以下转化:

(1)A的结构简式为: 。
(2)E是(写结构简式) ; D中含官能团名称 ;
(3)写出相应转化过程的反应化学方程式
②: 反应类型: 反应。
③: 反应类型: 反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com