
| A. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| B. | 镉元素属于重金属元素,食用‘镉大米’会影响骨骼和肾脏 | |
| C. | 使用增塑剂--邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)中阴、阳离子的个数之比为2:1 |
分析 A.二氧化硫可用作葡萄酒的抗氧化剂;
B.重金属能够使蛋白质变性;
C.增塑剂(又叫塑化剂)是一种增加塑料柔韧性、弹性等的添加剂;
D.过氧化钙阴离子为过氧根离子.
解答 解:A.二氧化硫具有较强的还原性,故常用作葡萄酒的抗氧化剂,故A错误;
B.重金属能够使蛋白质变性,有毒,镉元素属于重金属元素,食用‘镉大米’会影响骨骼和肾脏,故B正确;
C.邻苯二甲酸酯不能使聚氯乙烯由弹性塑胶变为硬塑胶,故C错误;
D.过氧化钙(CaO2)阳离子为钙离子,阴离子为过氧根离子,所以阴、阳离子的个数之比为1:1,故D错误;
故选:B.
点评 本题考查化学与生产、生活的关系,掌握相关物质的性质,能够用化学知识解释化学现象是解题关键,题目难度不大,注意对相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在主族元素中可以寻找制备催化剂及耐高温和耐腐蚀材料的元素 | |
| C. | 在过渡元素区域可以寻找制备新型农药材料的元素 | |
| D. | 非金属性最强的元素在元素周期表的最右上角 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | KMnO4溶液的浓(mol/L) | KMnO4溶液滴入的体积(mL) |
| 1 | 0.0200 | V1=20.02 |
| 2 | 0.0200 | V2=23.32 |
| 3 | 0.0200 | V3=19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
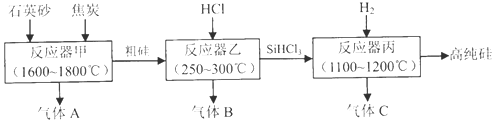
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量浓氨水滴入Al2(SO)4溶液 将少量Al2(SO4)3溶液滴入浓氨水 | |
| B. | 将少量SO2通入Ba(OH)2溶液 将过量SO2通入少量Ba(OH)2溶液 | |
| C. | 将0.1molCl2通入含0.2molFeBr2的溶液中 将0.3molCl2通入含0.2molFeBr2溶液 | |
| D. | 将过量BaCl2溶液与少量Na2SO4溶液相混合 将少量Ba(OH)2溶液与过量MgSO4溶液相混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| 待测溶液体积/mL | 25.00 | 25.00 | 25.00 | 25.00 |
| 滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
| 滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 只有⑤ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验室利用图①装置制取并收集氨气 | |
| B. | 利用图②装置测定盐酸的浓度 | |
| C. | 利用装置③验证碳酸的酸性强于苯酚 | |
| D. | 利用图④装置除去Cl2中的氯化氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com