
| 选项 | 实验目的 | 实验方案 |
| A | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
| D | 证明同温度下氯化银的溶解度大于硫化银的溶解度 | 向2 mL0.1 mol•L-1硝酸银溶液中加入1mL0.1mol•L-1 NaC1溶液,出现白色沉淀,再加入几滴0.1 mol•L-1的Na2S溶液,有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.同时加入食醋,生成具有漂白性的HClO;
B.加硫酸铜可构成原电池,加快反应速率;
C.亚硫酸钠可被硝酸氧化;
D.硝酸银过量,均为沉淀的生成.
解答 解:A.同时加入食醋,生成具有漂白性的HClO,则“84”消毒液的氧化能力随溶液pH的减小而增强,故A正确;
B.加硫酸铜可构成原电池,加快反应速率,则不能证明反应速率会随反应物浓度的增大而加快,故B错误;
C.亚硫酸钠可被硝酸氧化,不能溶于硝酸,应溶于盐酸,故C错误;
D.硝酸银过量,均为沉淀的生成,不发生沉淀的转化,则不能比较Ksp,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应速率、沉淀生成及转化、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 溶液X中一定含有Na+、Cl-和SiO32- | |
| B. | 溶液X中一定不含Ca2+、Br- | |
| C. | 为确定溶液X中是否含有SO42-,可取溶液2,加入BaCl2溶液 | |
| D. | 在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭 | |
| B. | 工业上电解熔融的MgCl2制Mg,推测:工业上电解熔融的AlCl3制Al | |
| C. | Fe与CuCl2溶液反应可以置换出Cu,推测:钠与CuCl2溶液反应也可以置换出Cu | |
| D. | Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,推测:Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 古文 | 解释 |
| A | 烧酒非古法也,自元时创始,其法用浓酒和糟入甑(指蒸锅),蒸令气上,用器承滴露 | 白酒(烧酒)的制造过程中采用了蒸馏的方法来分离和提纯 |
| B | 白青(碱式碳酸铜)得铁化为铜 | 可以用铁来冶炼铜 |
| C | 初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之 | 蔗糖的分离提纯采用了黄泥来吸附红糖中的色素 |
| D | 丹砂烧之成水银,积变又成丹砂 | 加热时丹砂(HgS)熔融成液态,冷却时重新结晶为HgS晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
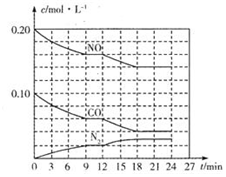 为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y与氢元素所形成的化合物分子只含有极性键 | |
| B. | W2Y、W2Y2中阴、阳离子个数比均为1:2 | |
| C. | Z的最高价氧化物对应水化物的酸性比R的强 | |
| D. | 将XY2通入W单质与水反应后的溶液中,生成的盐只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
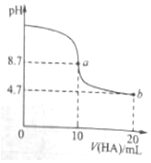 室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(A-)+c(HA)=0.1mol•L-1 | |
| B. | b点所示溶液中c(HA)>c(A-) | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | a、b两点所示溶液中水的电离程度a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com