
分析 三种醇混合后的平均相对分子质量=20.25×4=81,设三种醇的相对分子质量分别是8x、22x、29x,
设三种醇的物质的量分别是ymol、2ymol、ymol,其平均相对分子质量=$\frac{8xy+44xy+29xy}{4y}$=81,x=4,
所以这三种醇的相对分子质量分别是32、88、116,再结合饱和一元醇的通式CnH2n+2O确定A、B、C中碳原子个数,从而确定其分子式.
解答 解:三种醇混合后的平均相对分子质量=20.25×4=81,设三种醇的相对分子质量分别是8x、22x、29x,
设三种醇的物质的量分别是ymol、2ymol、ymol,其平均相对分子质量=$\frac{8xy+44xy+29xy}{4y}$=81,x=4,
所以这三种醇的相对分子质量分别是32、88、116,饱和一元醇的通式为CnH2n+2O,则A中碳原子个数=$\frac{32-16-2}{14}$=1、B中碳原子个数=$\frac{88-16-2}{14}$=5、C中碳原子个数=$\frac{116-16-2}{14}$=7,
所以A、B、C分子式分别为CH4O、C5H12O、C7H16O,
故答案为:CH4O;C5H12O;C7H16O.
点评 本题考查有机物分子式的确定,为高频考点,明确各个物理量的关系是解本题关键,侧重考查学生分析计算能力,知道饱和一元醇的通式、混合物相对分子质量的计算方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注.
中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注. ,则其在周期表中的位置是第四周期,VA族.
,则其在周期表中的位置是第四周期,VA族.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
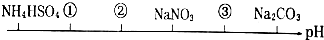
| A. | NH4Cl (NH4)2SO4 CH3COONa | B. | (NH4)2SO4 NH4Cl CH3COONa | ||
| C. | (NH4)2SO4 NH4Cl NaOH | D. | CH3COOH NH4Cl (NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、I-、NO3-、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、SO42-、Cu2+、NO3- | D. | NH4+、OH-、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com