
| A. | CH3COOH电离程度变大 | B. | 溶液pH减小 | ||
| C. | 溶液的导电能力减弱 | D. | 溶液中c(H+)减小 |
分析 CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度减小,溶液的pH增大,导电能力减弱,溶液中c(H+)减小;CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,溶液的PH增大,导电能力增强,溶液中c(H+)减小.
解答 解:A、CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度增大,加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,故A错误;
B、CH3COOH溶液加水稀释,平衡向正反应方向移动,溶液的PH增大,CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,溶液的pH增大,故B错误;
C、CH3COOH溶液加水稀释,离子浓度减小,溶液的导电能力减弱,加入少量CH3COONa晶体时,离子浓度增大,溶液的导电能力增强,故C错误;
D.加水稀释,促进醋酸电离,但溶液中氢离子浓度减小,加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,氢离子浓度减小,故D正确;
故选D.
点评 本题考查外界条件对电离平衡的影响,重点考查离子浓度以及同离子效应对电离平衡的影响,注意总结影响因素以及平衡移动的方向的判断.


科目:高中化学 来源: 题型:选择题
| A. | 6:11 | B. | 2:3 | C. | 2:5 | D. | 6:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①④⑤ | C. | 只有②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | BeCl2为共价化合物 | |
| B. | At2为无色固体,HAt不稳定,AgAt感光性强,但不溶于水也不溶于稀酸 | |
| C. | 硫酸钡是难溶于水的白色固体 | |
| D. | 硒化氢是无色、有毒、比H2S稳定的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
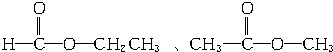 、
、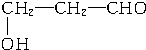 、
、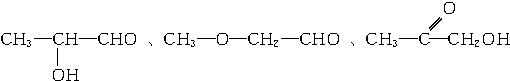 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 明矾水解时产生具有吸附性的胶体粒子 | 明矾可作自来水消毒 |
| B | Fe3+有氧化性 | FeCl3溶液可用于溶解回收旧电路板 中的铜 |
| C | NH4Cl受热分解 | 加热可将Ca(OH)2和NH4Cl固体混合物分离 |
| D | SO2具有氧化性 | SO2可用于漂白纸浆 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素A的单质不能把金属元素B从它的盐溶液中置换出来,一定可以说明金属性:A<B | |
| B. | 根据反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可说明C的非金属性比Si强 | |
| C. | 周期表中第n周期第n主族的元素均为金属 | |
| D. | 按照元素周期表的排布规律,非金属元素最多为23种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com