
 如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )
如图的装置,左为铁电极,右为石墨电极,a为水或某种溶液.若两电极直接连接或外接电源,石墨上可能发生的反应是( )| A. | ① | B. | ② | C. | ①② | D. | ①②③ |
分析 若两电极直接连接,则该装置是原电池,铁作负极,石墨作正极,负极上铁失电子发生氧化反应,正极石墨上得电子发生还原反应;
若两电极外接电源,则该装置为电解池,石墨电极若与正极相连,则为阳极,溶液中的阴离子失电子发生氧化反应,据此分析;
解答 解:若两电极直接连接,则该装置是原电池,铁作负极,石墨作正极,弱电解质为酸性溶液则正极石墨上发生2H++2e→H2↑,若电解质为中性溶液,则正极石墨上发生O2+4e+2H2O→4OH-;
若两电极外接电源,则该装置为电解池,石墨电极若与正极相连,则为阳极,如果电解氯化钠溶液,则电解反应为2Cl--2e→Cl2↑,所以①②③都有可能发生,
故选:D.
点评 本题考查原电池和电解池原理,根据电极上得失电子来分析解答,明确原电池的工作原理及电解质溶液的性质是解答本题的关键,电解过程的反应原理应用,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
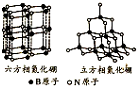 (1)短周期的元素a、b、c、d,原子序数依次增大.a原子的核外电子总数与其电子层数相同,b的基态原子各能级上排布的电子数相同,c的基态原子最高能层有3个未成对电子,d原子的最外层电子数为其内层电子数的3倍.
(1)短周期的元素a、b、c、d,原子序数依次增大.a原子的核外电子总数与其电子层数相同,b的基态原子各能级上排布的电子数相同,c的基态原子最高能层有3个未成对电子,d原子的最外层电子数为其内层电子数的3倍. (填电子式).
(填电子式).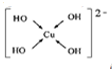 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
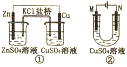
| A. | 装置中盐桥内的K+移向CuSO4溶液 | |
| B. | ①是将电能转变为化学能的装置 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置用于电解精炼钢,溶液中Cu2+的浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2 | B. | 酒精 | C. | CCl4 | D. | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物CH2=CH-CH3中碳的杂化类型有sp3 和sp2,其中有两个π键,7个σ键 | |
| B. | 分子CO和N2的原子总数相同,价电子总数相等 | |
| C. | Na+的电子排布式为1s22s22p6 | |
| D. | CO2分子的构型为直线型 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com