
【题目】已知

下列说法正确的是
A. 前20分钟内反应放出的热量为46.2kJ
B. 第25分钟改变的条件可以是将NH3从反应体系中分离出去
C. 若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件一定是增大压强
D. 时段I,若仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变
【答案】BD
【解析】
根据化学反应速率的定义和影响化学平衡的因素进行判断。减小生成物浓度,平衡正向移动;降低温度,平衡向着放热的方向移动;增大压强,平衡向着气体体积减小的方向移动。据此解答。
A.要想知道放热多少就必须知道H2的物质的量,又由于c=![]() ,由于缺少容器的体积,所以不能计算具体放热多少,A错误;
,由于缺少容器的体积,所以不能计算具体放热多少,A错误;
B.第25分钟时,氨气的浓度由1.00mol/L变为0,说明改变的条件是将NH3从反应体系中分离出去,B正确;
C.由图可知,氢气和氮气的浓度减小,氨气的浓度增大,若为增大压强(压缩体积),则各物质的浓度都比原来要大,C错误;
D.恒容容器,增大反应物起始浓度,相当于增大压强,合成氨反应的平衡正向移动,反应物的转化率增大,但平衡常数保持不变,D正确;
故合理选项是BD。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知3.0 g乙烷完全燃烧在常温下放出的热量为155.98 kJ,则下列关于乙烷燃烧热的热化学方程式书写正确的是
A. 2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-3119.6 kJ/mol
B. C2H6(g)+5/2O2(g)===2CO(g)+3H2O(g) ΔH=-1559.8 kJ/mol
C. C2H6(g)+7/2O2(g)===2CO2(g)+3H2O(g) ΔH=-1559.8 kJ/mol
D. C2H6(g)+7/2O2(g)===2CO2(g)+3H2O(l) ΔH=-1559.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g);
CO(g)+H2(g);
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g);
CO2(g)+H2(g);
现有下列状态:①混合气体平均相对分子质量不再改变 ②恒温时,气体压强不再改变 ③各气体组成浓度相等 ④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1,其中能表明甲、乙容器中反应都达到平衡状态的是
(1)其中能表明甲容器中反应都达到平衡状态的是____________________
(2)其中能表明乙容器中反应都达到平衡状态的是_______________________
(3)其中能表明甲、乙容器中反应都达到平衡状态的是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是( )

A.Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
B.Q的最高价氧化物的水化物的酸性比Z的强
C.X氢化物的稳定性比Q强
D.Y的原子半径比X的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为氢氧燃料电池的装置示意图,下列说法正确的是

A. 该装置能将化学能转化为电能
B. 通入氧气的电极为负极
C. 电子由电极B经导线流向电极A
D. 正极反应式为:H2 – 2e- = 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E代表单质或化合物,它们之间的相互转换关系如图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。

请回答:
(1)形成单质A的原子的结构示意图为________。
(2)E的化学式为________。
(3)B与氢氧化钠反应生成D和H2O的化学方程式是________。
(4)在D的溶液中通入过量CO2气体的离子方程式________。
(5)下列说法正确的是______
A 水泥、玻璃、石英玻璃等都是传统硅酸盐材料。B 高纯度的硅单质广泛用于制作光导纤维。
C 化学分析中常用到的分子筛是硅酸盐材料。D 熔融烧碱不能选用陶瓷坩埚。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.苯与溴水、酸性高锰酸钾溶液不反应,说明苯分子中碳原子间只存在单键
B.煤是由有机物和无机物所组成的复杂的混合物
C.相同质量的烷烃完全燃烧时,甲烷的耗氧量最高
D.乙烯可在催化剂作用下与H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用17.10 g Ba(OH)2固体配成250mL溶液待用。利用上述所配制的溶液测定Na2SO4和NaHSO4混合物的组成。(计算结果保留三位有效数字)
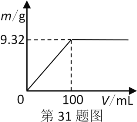
(1)配制的Ba(OH)2溶液的物质的量浓度_____mol·Lˉ1。
(2)现称取5.24g该固体混合物,配成100mL溶液。逐滴加入上述Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。当产生沉淀最多时,混合溶液中c(OH-)为________mol·L-1(忽略体积变化)。
(3)混合物中n[Na2SO4]∶n(NaHSO4)为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com