
| A. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成4种二肽 | |
| C. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| D. | 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
分析 A.水解为断开C-O键,据此解答即可;
B.氨基酸形成肽键原理为羧基提供-OH,氨基提供-H,两个氨基酸分子脱去一个水分子脱水结合形成二肽,既要考虑不同氨基酸分子间生成二肽,又要考虑同种氨基酸分子间形成二肽;
C.苯甲酸可与生石灰反应;
D.乙炔中混有的杂质H2S、PH3具有还原性.
解答 解:A.乙酸和乙醇发生酯化反应时,乙酸中C-O键断裂,乙醇中O-H键断裂,则水解可分别形成C-O键和O-H键,则在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH,故A错误;
B.氨基酸生成二肽,就是两个氨基酸分子脱去一个水分子.当同种氨基酸脱水,生成2种二肽;当是异种氨基酸脱水:可以是甘氨酸脱去羟基,丙氨酸脱氢;也可以丙氨酸脱羟基,甘氨酸脱去氢,生成2种二肽,共4种,故B正确;
C.苯甲酸可与生石灰反应,生成的盐不挥发,可用蒸馏的方法分离,故C正确;
D.乙炔中混有的杂质H2S、PH3具有还原性,也能使溴的四氯化碳溶液褪色,故D错误,故选BC.
点评 本题考查有机物的鉴别,侧重于有机物的结构和性质的考查,为高频考点,注意把握物质的性质的异同以及鉴别的方法的选取,注意相关基础知识的积累,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
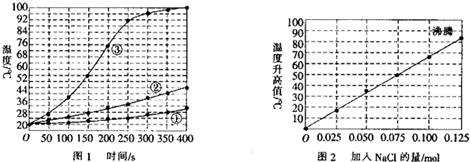
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na原子最外层有1个电子 | B. | Na单质能跟水反应放出氢气 | ||
| C. | Na原子比Mg原子更易失去电子 | D. | Na与氧气在加热条件下生成氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2→CH3CH2Cl | B. | CH≡CH→CH3-CH3 | ||
| C. | CH3CH2OH→CH2=CH2 | D. | 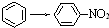 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
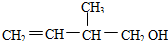 下列的叙述错误的是( )
下列的叙述错误的是( )| A. | 此有机物的官能团是羟基和碳碳双键 | |
| B. | 能在催化剂条件下与H2发生加成反应 | |
| C. | 此有机物不能发生加聚反应 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
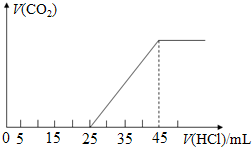
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com