
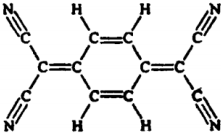
| A. | 分子中所有的氮原子在同一平面内 | B. | 属于芳香烃 | ||
| C. | 分子式为C12H4N4 | D. | 该物质易溶于水 |
分析 A.该物质中含有碳碳双键和碳氮三键,根据乙烯和乙炔的结构简式确定确定原子共面;
B.只含C、H元素且含有苯环的烃为芳香烃;
C.根据结构简式确定分子式;
D.该物质中不含亲水基只含憎水基.
解答 解:A.该物质中含有碳碳双键和碳氮三键,乙烯分子中所有原子共平面,乙炔分子中所有原子共直线,所以该分子中N原子共平面,故A正确;
B.只含C、H元素且含有苯环的烃为芳香烃,该分子中还含有N元素且没有苯环结构特点,所以不属于芳香烃,故B错误;
C.根据结构简式确定分子式为C12H4N4,故C正确;
D.该物质中不含亲水基只含憎水基,所以该分子不易溶于水,故D错误;
故选BD.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确基本概念、物质结构特点是解本题关键,采用知识迁移方法分析解答,题目难度不大.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:实验题
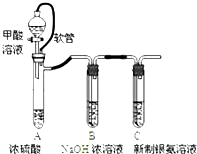 | 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与软脂酸属于同系物的最简单有机物是甲酸 | |
| B. | 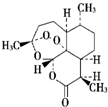 青蒿素是抗疟疾特效药,结构如图所示,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,能够发生水解反应,具有强氧化性 | |
| C. | 油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应 | |
| D. | 有X、Y两种有机物,不论何种比例混合,只要其物质的量之和不变,完全燃烧时耗氧气量和生成水的物质的量也不变,若X为CH4,则Y可以是CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +1 | +3 | +7 | +5 | - |
| 最低负价 | -1 | - | - | -1 | -3 | -2 | |
| A. | 离子半径:Y>Z>M | |
| B. | Y、Z、M三种元素的最高价氧化物的水化物两两之间会反应 | |
| C. | 化合物XM、YM都是电解质.熔融状态下都能导电 | |
| D. | 元素Z、M、R的离子均能破坏水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏水中滴加稀H2SO4,c(H+)和KW都增大 | |
| B. | 在Na2S稀溶液中,c(OH-)+c(HS-)+2c(S2-)═c(H+)+c(Na+) | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 等体积0.2mol/LHCl溶液与0.05mol/LBa(OH)2溶液混合后,溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | B. | CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | ||
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | D. | 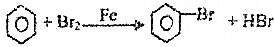 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com