
【题目】石油产品中除含有H2S外,还含有各种形态的有机硫,如COS、CH3SH等。
回答下列问题:
(1)CH3SH(甲硫醇)的电子式为__________。
(2)CO和H2S反应可产生羰基硫( COS)。在一恒容密闭容器中发生反应:CO(g)+H2S(g)![]() COS(g)+H2(g)并达到平衡,数据如下表所示:
COS(g)+H2(g)并达到平衡,数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应是________反应(填“吸热”或“放热”)。
②实验1达平衡时,CO的转化率为_______。
③实验2达到平衡时,a_______7.0(填“大于”“小于”或“等于”)。
④实验3达平衡后,再充入1.0 molH2,平衡常数值____(填“增大”“减小”或“不变”)。
(3)COS是大气污染物。在酸性溶液中可用H2O2氧化COS生成一种强酸脱硫。该脱除反应的化学方程式为_______________。
(4)有一种脱硫工艺为:真空K2CO3一克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3 +H2S =KHS +KHCO3,该反应的平衡常数的对数值为lgK=_____(已知:H2CO3 lgK1=-6.4,lgK,2=- 10.3;H2S lgKl=-7.0,lgK2
②已知下列热化学方程式:
a. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H1=-1172kJ/mol
b. 2H2S(g)+O2(g)=2S(s)+2H2O(1) △H2 = 632 kJ/mol
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为_________。
【答案】 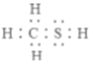 放热 30% 小于 不变 COS + 4H2O2 = CO2 + H2SO4+ 3H2O 3. 3 2H2S (g) +SO2 (g) =3S (s) +2H2O (1) △H=-362kJ/mol
放热 30% 小于 不变 COS + 4H2O2 = CO2 + H2SO4+ 3H2O 3. 3 2H2S (g) +SO2 (g) =3S (s) +2H2O (1) △H=-362kJ/mol
【解析】(1)CH3SH (甲硫醇)是共价化合物,硫原子形成两个共价键,碳原子形成四个共价键,电子式为; ,故答案为:
,故答案为: ;
;
(2)①实验1和实验3,如果温度不变,平衡时实验的n(CO)=7.0×2=14mol,而现在是16mol,说明升高温度平衡逆向移动,逆反应是吸热,正反应是放热,故答案为:放热;
②CO的转化率为![]() ×100%=30%,故答案为:30%;
×100%=30%,故答案为:30%;
③150℃,K=![]() =
=![]() ,而Qc=
,而Qc=![]() =
=![]() ,即Qc<K,反应向正反应方向移动,所以实验2达平衡时,a<7.0,故答案为:小于;
,即Qc<K,反应向正反应方向移动,所以实验2达平衡时,a<7.0,故答案为:小于;
④K是温度的函数,温度不变K不变,而充入1.0 mol H2,所以K值不变,故答案为:不变;
(3)在酸性溶液中,H2O2氧化COS生成一种强酸为硫酸,反应的化学方程式为COS + 4H2O2 = CO2 + H2SO4+ 3H2O,故答案为:COS + 4H2O2 = CO2 + H2SO4+ 3H2O;
(4)①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数K=![]() =
=![]() ,lgK=LgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3,故答案为:3.3;
,lgK=LgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3,故答案为:3.3;
②a.2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H1=-1172kJ/mol,b.2H2S(g)+O2(g)═2S(s)+2H2O(l) △H2=-632 kJ/mol,盖斯定律计算(b×3-a)×![]() 得到克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s)反应的热化学方程式:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=-362 kJmol-1,故答案为:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=-362kJmol-1。
得到克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s)反应的热化学方程式:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=-362 kJmol-1,故答案为:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=-362kJmol-1。


科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(s)的能量变化如图所示,判断下列叙述中错误的是( )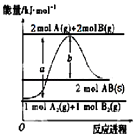
A.该反应热△H=+(a﹣b)kJmol﹣1
B.AB(g)═A(g)+B(g)△H=+b/2kJmol﹣1
C.断裂1 mol A﹣A键和1 mol B﹣B键,吸收a kJ能量
D.该反应在任何条件下都不可能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2分子结构如图所示。常温下,S2Cl2遇水易水解并产生能使品红褪色的气体。下列说法不正确的是

A. S2Cl2分子中所有原子不在同一平面
B. 13.5 gS2Cl2中共价键的数目为0.4NA
C. S2Cl2与水反应时S-S、S-C1键都断裂
D. S2Cl2中S-S键和S-C1键是共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大。Z在短周期主族元素中原子半径最大;m、n、p、q为它们的单质;常温下,q为黄绿色气体,a为无色液体;各物质间转化关系如图所示。下列说法不正确的是

A. d中可能含有非极性共价键
B. Y、Z、W分别与X形成的化合物沸点:Z<Y<W
C. m在q中燃烧,产生大量白雾
D. 元素非金属性:Y>W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组通过铁与盐酸反应的实验,研究影响反应速率的因素(铁的质量相等,铁块的形状一样,盐酸均过量),设计实验如下表:
实验编号 | 盐酸浓度/(mol/L) | 铁的形态 | 温度/K |
1 | 4.00 | 块状 | 293 |
2 | 4.00 | 粉末 | 293 |
3 | 2.00 | 块状 | 293 |
4 | 2.00 | 粉末 | 313 |
(1)若四组实验均反应进行1分钟(铁有剩余),则以上实验需要测出的数据是______。
(2)实验___和_____(填实验编号)是研究盐酸的浓度对该反应速率的影响;实验1和2是研究_______对该反应速率的影响。
(3)测定在不同时间产生氢气体积V的数据,绘制出图甲,则曲线c、d分别对应的实验组别可能是______、______。

(4)分析其中一组实验,发现产生氢气的速率随时间变化情况如图乙所示。
①其中t1~t2速率变化的主要原因是______。
②t2~t3速率变化的主要原因是___________ 。
(5)实验1产生氢气的体积如丙中的曲线a,添加某试剂能使曲线a变为曲线b的是______。
A.CuO粉末 B.NaNO3固体 C.NaCl溶液 D.浓H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道,能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺流程如下:

(1)“分子筛”的化学式用氧化物形式可表示为_______________。
(2)铝灰水解产生的气体为________(填化学式),该气体分子中极性键的数目为___________;“水解”在加热条件下而不在室温下进行的原因是________________________。
(3)“酸溶”时,发生氧化还原反应的离子方程式为_________________________________。
(4)该工艺中滤渣的颜色为________________________。
(5)某学习小组设计实验模拟从浓缩海水(含Ca2+、Mg2+、SO42-)中提取试剂级NaCl:
![]()
①实验中若向浓缩海水中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出。该反应的离子方程式为__________________________________。
②该学习小组发现上述实验即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。从平衡角度分析其原因:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )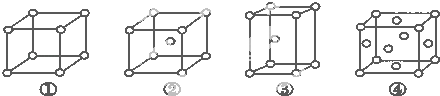
A.①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积
B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为:①6,②8,③8,④12
D.空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com