
| A. | 等体积、等浓度的K2CO3溶液与盐酸混合,则混合液中:c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 向氨水中滴加盐酸至中性,则溶液中:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| C. | 等体积、等浓度的CH3COOH溶液与NaOH溶液混合后,溶液的pH=8,则c(OH-)-c(CH3COOH)=1×10-8mol•L-1 | |
| D. | 等体积、等浓度①NaCl、②CH3COONa、③NaClO溶液中离子总数大小顺序:③>②>① |
分析 A.等体积、等浓度的K2CO3溶液与盐酸混合反应得到KCl和KHCO3溶液,据此分析离子浓度大小;
B.溶液中为氯化铵和一水合氨混合溶液,结合电荷守恒分析;
C.等体积、等浓度的CH3COOH溶液与NaOH溶液混合后,溶液的pH=8,溶液为醋酸钠溶液,溶液中存在质子守恒计算分析;
D.NaCl是强酸强碱盐,不水解;而醋酸钠和次氯酸钠是弱酸强碱盐,能水解,次氯酸根离子水解长度大于醋酸根,根据两溶液中的电荷守恒来分析.
解答 解:A.等体积、等浓度的K2CO3溶液与盐酸混合反应得到KCl和KHCO3溶液,混合液中:c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+),故A正确;
B.向氨水中滴加盐酸至中性,c(OH-)=c(H+),溶液中存在电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-)则溶液中:c(NH4+)=c(Cl-)>c(OH-)=c(H+),故B正确;
C.等体积、等浓度的CH3COOH溶液与NaOH溶液混合后,溶液的pH=8,溶液为醋酸钠溶液,溶液中存在质子守恒c(OH-)=c(CH3COOH)+c(H+),c(OH-)-c(CH3COOH)=c(H+)=1×10-8mol•L-1 ,故C正确;
D.等体积、等浓度的NaCl溶液中的电荷守恒有:c(Na+)+c(H+)=c(Cl-)+c(OH-);
CH3COONa溶液中的电荷守恒有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-);
NaClO溶液中的电荷守恒有:c(Na+)+c(H+)=c(ClO-)+c(OH-);
溶液中的c(Na+)相同,但由于氯化钠是强酸强碱盐,不水解,溶液显中性,而醋酸钠是弱酸强碱盐,能水解,溶液显碱性,故氯化钠溶液中的c(H+)大于CH3COONa溶液中的c(H+),则有:c(Cl-)+c(OH-)>c(CH3COO-)+c(OH-),故有NaCl溶液中c(Na+)+c(H+)+c(Cl-)+c(OH-)大于CH3COONa溶液中的c(Na+)+c(H+)+c(CH3COO-)+c(OH-);即溶液中离子总数:NaCl溶液>CH3COONa溶液,NaClO溶液中氢离子浓度c(H+)小于NaClO溶液,c(ClO-)+c(OH-)<c(CH3COO-)+c(OH-),溶液中离子总数大小顺序:③<②<①,故D错误;
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较、电荷守恒、物料守恒关系的判断、反应后溶液中溶质和酸碱性的理解,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{b}{4a}$mol-1 | B. | $\frac{a}{4b}$mol-1 | C. | $\frac{a}{b}$ mol-1 | D. | $\frac{b}{a}$mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质参加的化学反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应一定是氧化还原反应 | |
| C. | 某种物质中只含有一种元素一定是纯净物 | |
| D. | 酸和盐一定能发生复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
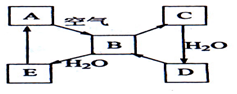 如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C含有的元素种类相同,且相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C含有的元素种类相同,且相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的0.1mol/L NaHA溶液:c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A) | |
| B. | 10mL 0.1mol/L CH3COOH溶液与20mL 0.1mol/L NaOH溶液混合后,溶液中离子浓度关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| C. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1<10c2 | |
| D. | 已知:HA为弱酸,则两种溶液①0.1mol/LHA溶液;②0.3mol/LHA溶液与0.1mol/LNaOH溶液等体积的混合液,c(H+)①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的硫磺和甲基苯酚都可以添加到肥皂中做消毒剂 | |
| B. | 可以通过煤的干馏得到苯、二甲苯等化工原料粗品 | |
| C. | 神州十一号航天员的航天服由碳化硅陶瓷和碳纤维复合制成,它是一种新型无机复合材料 | |
| D. | 经过一定化学变化,可以从海水中提取氯化钠或镁等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气还原氧化铜 | |
| B. | 二氧化碳与氢氧化钠溶液作用生成碳酸氢钠 | |
| C. | 硫化氢通入氯化铁溶液中生成硫、氯化亚铁和盐酸 | |
| D. | 氯酸钾分解制氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量之比为1:1 | B. | 质量之比为4:1 | ||
| C. | 物质的量之比为l:2 | D. | 质量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| W | Z |
| A. | 最高价氧化物的水化物的酸性:X<Z | |
| B. | 电负性大小:Y<Z | |
| C. | 离子半径大小:W<Y | |
| D. | W的最高价氧化物的水化物具有两性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com