
| A. | AlCl3 | B. | KHCO3 | C. | Fe2(SO4)3 | D. | FeSO4 |
科目:高中化学 来源: 题型:选择题
| A. | 它们的分子数目之比是 4:5 | B. | 它们的氧元素的质量之比为 2:3 | ||
| C. | 它们的物质的量之比为 5:4 | D. | 它们的密度之比为 5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2$\stackrel{NaBr(aq)}{→}$Br2$\stackrel{SO_{2}(aq)}{→}$HBr | |
| B. | Fe3O4$→_{高温}^{CO}$Fe$\stackrel{HCl(aq)}{→}$FeCl3 | |
| C. | NaCl$\stackrel{NH_{4}HCO_{3}(aq)}{→}$Na2CO3$\stackrel{Ca(OH)_{2}}{→}$NaOH | |
| D. | Cu2(OH)2CO3$\stackrel{HCl(aq)}{→}$CuCl2$\stackrel{NaNO_{3}(aq)}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
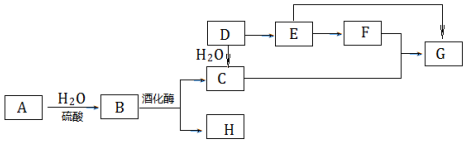
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属材料 | B. | 复合材料 | C. | 无机非金属材料 | D. | 合成高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3与NH3•H2O | B. | NaOH与CO2 | C. | Na2CO3与HCl | D. | Na与O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用互滴的方法鉴别NaOH溶液和AlCl3溶液 | |
| B. | 除去MgCl2中少量AlCl3可用氨水 | |
| C. | 用KSCN溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 | |
| D. | 用丁达尔效应鉴别NaCl溶液和KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
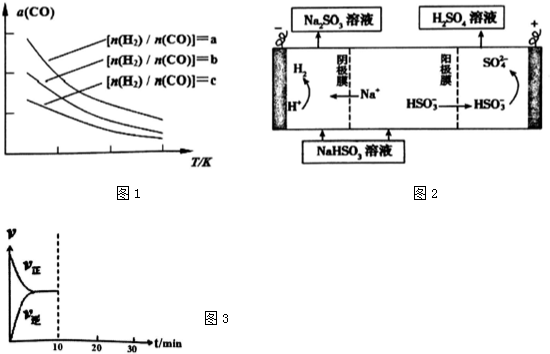
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 ml,1mol/LFe2(SO4)3溶液和250mL 3mol/L的Na2SO4溶液所含硫酸根离子的物质的量浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2gNaHSO4晶体中阳离子和阴离子的总数为0.03NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中.Na+的物质的量浓度为lmol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com