
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1 mo1/L盐酸中含1 mo1HCl分子 | |
| C. | 在标准状况下,22.4 LCH4与18gH2O所含有的分子数均为NA | |
| D. | 22.4L的CO气体与1mol N2所含的电子数一定相等 |
分析 A.n(Mg)=$\frac{2.4g}{24g/mol}$=0.1mol,N(Mg)=0.1NA,每个变为镁离子失去两个电子;
B.由n=cV可知,缺少溶液的V,无法计算溶质的物质的量;
C.n(CH4)=$\frac{22.4L}{22.4L/mol}$=1mol,n(H2O)=$\frac{18g}{18g/mol}$=1mol,CH4与H2O都是由分子构成的;
D.22.4L的CO气体的物质的量无法计算.
解答 解:A.n(Mg)=$\frac{2.4g}{24g/mol}$=0.1mol,N(Mg)=0.1NA,每个变为镁离子失去两个电子,因此失去的电子数为0.1NA×2=0.2NA,故A错误;
B.由n=cV可知,缺少溶液的V,无法计算溶质的物质的量,故B错误;
C.n(CH4)=$\frac{22.4L}{22.4L/mol}$=1mol,n(H2O)=$\frac{18g}{18g/mol}$=1mol,CH4与H2O都是由分子构成的,因此所含有的分子数均为NA,故C正确;
D.22.4L的CO气体的物质的量无法计算,因此无法进行比较,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各物理量与阿伏加德罗常数的关系.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 水分子不可再分 | |
| B. | 水分子由氢和氧两种元素组成 | |
| C. | 水分子由氧原子和氢原子构成 | |
| D. | 二氧化碳分子是保持干冰化学性质的最小微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
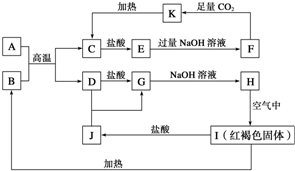 已知A~K均为中学化学的常见物质,它们之间的转化关系如下图所示,其中A是铝,且A+B→C+D是置换反应,反应过程中生成的水及其他部分产物已略去.
已知A~K均为中学化学的常见物质,它们之间的转化关系如下图所示,其中A是铝,且A+B→C+D是置换反应,反应过程中生成的水及其他部分产物已略去.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯能使鲜花褪色 | |
| B. | 蒸馏实验中,温度计水银球应位于蒸馏烧瓶支管口处 | |
| C. | 只用BaCl2溶液就可以鉴别SO42-和CO32- | |
| D. | 在实验室里,硅酸钠溶液存放在带磨口玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池负极的电极反应为:Al-3e-═Al3+ | |
| B. | 该电池可能是一种可充电的二次电池 | |
| C. | 消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多 | |
| D. | 电池工作时,溶液中铝离子向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com