
【题目】在pH=1的溶液中,下列离子组能大量共存且溶液为无色透明的是C
A.Na+、K+、OH-、Cl-
B.Na+、Cu2+ 、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl-
D.Ba2+、HCO3-、NO3-、K+
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 电子层结构相同的微粒,其化学性质—定相似
B. 第三周期非金属元素含氧酸的酸性从左到右依次增强
C. 非金属元素的原子两两结合形成的化合物不一定是共价化合物
D. 元素周期律是元素原子核外电子排布周期性变化的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
(1)氧化产物是__________,还原产物是________。
(2)氧化剂与还原剂的物质的量之比是________。
(3)当有2 mol HNO3参加反应时,被氧化的物质是_____________ mol ,电子转移数目约为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000 mol·L-1NaOH溶液分别滴定20.00ml 0.1000 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )

A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH) =10.00mL时,醋酸溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.V(NaOH) =20.00mL时,两溶液中 c(CH3COO-)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见化学物质的应用正确的是
A. 干冰能用作冷冻剂
B. 氯化钠可用作净水剂
C. 味精可用作食品调味剂
D. 小苏打是一种膨松剂,可用于制作馒头和面包
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 1molL﹣1Al2(SO4)3溶液中,含Al3+离子的物质的量( )
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物的反应机理,对于消除对环境的污染有重要意义。升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)![]() 2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)
2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快);v1正=k1正c2(NO);v1逆=k1逆c(N2O2)H1<0
N2O2(g)(快);v1正=k1正c2(NO);v1逆=k1逆c(N2O2)H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢);v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)H2<0
2NO2(g)(慢);v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)H2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H= (用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H= (用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1 E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是 。
2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1 E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是 。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
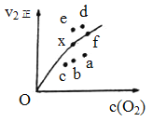
由实验数据得到v2正~[O2]的关系可用右图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为 (填字母)。
(3)工业上可用氨水作为NO2的吸收剂,NO2通入氨水发生的反应:2NO2+2NH3·H2O=NH4NO3+NH4NO2+H2O。若反应后的溶液滴入甲基橙呈红色,则反应后溶液中c(NH4+) c(NO3-)+c(NO2-)(填“>”“<”或“=”)。工业上也可用电解法处理氮氧化物的污染。电解池如图所示,阴阳电极间是新型固体氧化物陶瓷,在一定条件下可传导O2-。
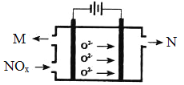
该电解池阴极的电极反应式是 。阳极产生的气体N的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2升的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?) xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4。下列判断不正确的是( )
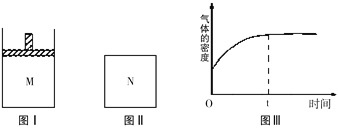
A、x=2
B、若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C、A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D、若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com