
| A. | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Na+Cl2↑ | B. | Al2O3+3H2 $\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | ||
| C. | Fe2O3+3CO $\frac{\underline{\;\;△\;\;}}{\;}$ 2 Fe+3CO2 | D. | MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ |
分析 A.钠性质活泼,工业上用电解质融入氯化钠方法制备;
B.金属镁性质活泼,工业上用电解熔融氯化镁方法制备;
C.铁性质较活泼,用热还原法制备;
D.金属镁性质活泼,工业上用电解熔融氯化镁方法制备;
解答 解:A.钠性质活泼,工业上用电解质融入氯化钠方法制备,方程式:2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Na+Cl2↑,故A正确;
B.金属镁性质活泼,工业上用电解熔融氯化镁方法制备,方程式:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$ Mg+Cl2↑,故B错误;
C.铁性质较活泼,用热还原法制备,化学方程式:Fe2O3+3CO $\frac{\underline{\;\;△\;\;}}{\;}$ 2 Fe+3CO2,故C正确;
D.金属镁性质活泼,工业上用电解熔融氯化镁方法制备,方程式:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$ Mg+Cl2↑,故D正确;
故选:B.
点评 本题考查了金属冶炼的一般原理,注意根据金属的活泼性不同采取相应的冶炼方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是硅 | |
| B. | 硅很活泼,在自然界中没有游离态形式 | |
| C. | 硅酸钠可用于木材防火 | |
| D. | SiO2与烧碱和氢氟酸都能反应,是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2H2O 反应类型为:酯化反应.
+2H2O 反应类型为:酯化反应.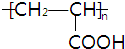 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解某溶液时,若两极分别只有H2和O2生成,电解一段时间后,该溶液的浓度可能减小 | |
| B. | 电解精炼铜时,电解质溶液中铜离子浓度不变 | |
| C. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快 | |
| D. | 要使电解后的CuSO4溶液复原,可向其中加人Cu(OH)2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性;Na+<Mg2+<Al3+ | B. | 半径:C1->S2->F- | ||
| C. | 稳定性:HF>HCl>HBr>HI | D. | 酸性:HClO4>H2SO4>H2CO3>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
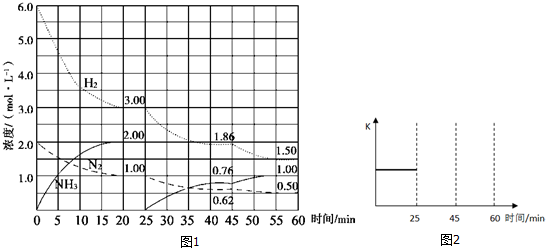
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ③④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | BaCl2 | C. | NaOH | D. | Ba(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com