
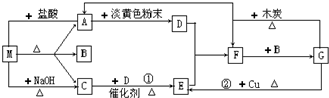
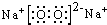 ,故答案为:
,故答案为: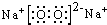 ;
;
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
| A、Ag+、Cu2+、NO3-、Na+ |
| B、K+、Ba2+、Cl-、NO3- |
| C、Na+、Ca2+、Cl-、CO32- |
| D、Na+、Mg2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
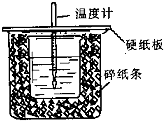 已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如图,回答下列问题:
已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如图,回答下列问题:| 实 验 用 品 | 溶液温度(℃) | 中和热△H(kJ?mol-1) | |||
| t1 | t2 | ||||
| ① | 50 mL 0.50 mol?L-1NaOH | 50 mL 0.50 mol?L-1HCl | 20 | 23.3 | |
| ② | 50 mL 0.50 mol?L-1NaOH | 50 mL 0.50 mol?L-1HCl | 20 | 23.5 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL 0.55mol?L-1NaOH |
50mL 0.5mol?L-1HCl |
20℃ | 23.3℃ | |
| ② | 50mL 0.55mol?L-1NaOH |
50mL 0.5mol?L-1HCl |
20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸具有强氧化性,稀硫酸无氧化性 |
| B、浓硫酸不慎沾到皮肤上,立即用大量的水冲洗 |
| C、稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢地注入盛有水的烧杯中,并不断搅拌 |
| D、浓硫酸与碳的反应中,浓硫酸仅表现强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com