接触法制硫酸排放的尾气中,含少量的二氧化硫.
(1)为了测定尾气中二氧化硫的体积分数,取10.0L尾气(标准状况)缓慢通过足量的溴水,然后在此溶液中加入过量的BaCl
2溶液,产生白色沉淀,将沉淀过滤、洗涤、干燥后称重为0.233g.则尾气中二氧化硫的体积分数为
.
(2)某研究小组用氨水吸收尾气中的SO
2,再向吸收液中加入硫酸,制取高浓度的SO
2气及(NH
4)
2SO
4和NH
4HSO
4固体.为测定所得固体样品中(NH
4)
2SO
4和NH
4HSO
4的含量,现称取该样品四份,分别和80.0mL相同浓度的NaOH溶液混合,并加热到90℃左右,充分反应,使氨气全部逸出[设此时(NH
4)
2SO
4和NH
4HSO
4均没发生自身的分解].测得有关实验数据如下表(气体体积均已折算为标准状况):
| 实验序号 |
样品质量/g |
氢氧化钠溶液的体积/mL |
氨气的体积/L |
| Ⅰ |
14.8 |
80.0 |
3.36 |
| Ⅱ |
29.6 |
80.0 |
4.48 |
| Ⅲ |
44.4 |
80.0 |
2.24 |
| Ⅳ |
74.0 |
80.0 |
0.00 |
据此,请回答:(写出计算过程)
①当用7.4g该样品和80.0mL相同浓度的氢氧化钠溶液混合而进行同样的实验时,在标准状况下生成氨气的体积为
.
②试计算该样品中(NH
4)
2SO
4和NH
4HSO
4的物质的量之比
.
③欲计算实验所用的氢氧化钠溶液的物质的量浓度,则应选择序号
的实验数据,由此求得氢氧化钠溶液的物质的量浓度为
.
(3)将尾气通入含有a mol NaOH的溶液中,充分反应,对此请画出n(Na
2SO
3)、n(NaHSO
3)随尾气中n(SO
2)的变化曲线.

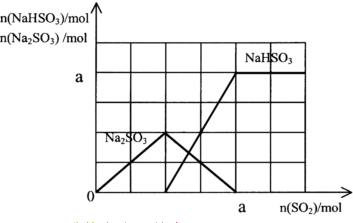 ,
, .
.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案