
| A. | 元素b的简单气态氢化物的热稳定性比e的弱 | |
| B. | 元素c的最高价氧化物对应水化物的碱性比d的强 | |
| C. | 简单离子半径r:c>d>e>b | |
| D. | 元素a、b、e各自最高和最低化合价的代数和分别为0、4、4 |
分析 a、b、c、d、e是原子序数依次增大的短周期元素,a是周期表中原子半径最小的元素,a为H;b2-和c2+的电子层结构相同,则b为O,c为Mg;e的核电荷数是b的2倍,e为S;元素d的合金是日常生活中使用最广泛的金属材料之一,d为Al,以此来解答.
解答 解:由上述分析可知,a为H,b为O,c为Mg,d为Al,e为S,
A.非金属性b>e,则b的简单气态氢化物的热稳定性比e的强,故A错误;
B.金属性c>d,则c的最高价氧化物对应水化物的碱性比d的强,故B正确;
C.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径r:e>b>c>d,故C错误;
D.b为O,无最高正价,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
| 实验 | 操作 | 现象 |
| a | 向2mL 0.1mol/LNa2S溶液中滴加3滴KMnO4溶液, 振荡,静置 | 溶液中出现黄色浑浊,得到淡黄色沉淀、无色溶液 |
| b | 向2mL 1.0mol/LNa2S溶液中滴加3滴KMnO4溶液, 振荡,静置 | 溶液中出现黄色浑浊,浑浊消失,得到浅黄色溶液 |
| c | 向2mL 2.4mol/LNa2S溶液中滴加3滴KMnO4溶液, 振荡,静置 | 有肉红色固体生成,上清液为 浅黄色 |
| d | 向 2mL KMnO4 溶液中滴加 0.1mol/L Na2S 溶液 | 立即有臭鸡蛋气味气体生成,稍后,有棕褐色固体生成 |
| e | 取少量d中所得固体,滴加 1.0mol/L Na2S 溶液,振荡,静置 | 得到黑色固体,浅黄色溶液 |
 (5)实验d中,两溶液混合后立即发生的复分解反应可能干扰氧化还原反应的进行,请设计实验,在排除上述干扰的前提下探究等体积的 KMnO4 溶液与 0.1mol/L Na2S 溶液反应的可能的还原产物.(已知:该条件 KMnO4 可反应完全).(请将实验装置补充充整,标出所用试剂,并描述实验操作)
(5)实验d中,两溶液混合后立即发生的复分解反应可能干扰氧化还原反应的进行,请设计实验,在排除上述干扰的前提下探究等体积的 KMnO4 溶液与 0.1mol/L Na2S 溶液反应的可能的还原产物.(已知:该条件 KMnO4 可反应完全).(请将实验装置补充充整,标出所用试剂,并描述实验操作) 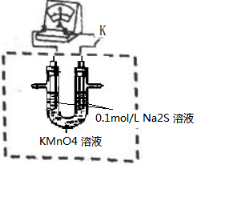 图组装好装置,闭合开关K,(发现指针偏转.)待指针归零后,观察右管内有无沉淀生成.若有,则还原产物包含MnO2.用胶头滴管吸取U型管右管内上清液1mL于试管中,加入过量2.4mol/LNa2S溶液,若有肉红色固体生成,则还原产物还包含Mn2+
图组装好装置,闭合开关K,(发现指针偏转.)待指针归零后,观察右管内有无沉淀生成.若有,则还原产物包含MnO2.用胶头滴管吸取U型管右管内上清液1mL于试管中,加入过量2.4mol/LNa2S溶液,若有肉红色固体生成,则还原产物还包含Mn2+查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 会形成酸雨,造成森林大面积死亡 | |
| B. | 会使地球温度升高,冰川融化,生态失衡 | |
| C. | 会使人体吸进大量二氧化碳,损害健康 | |
| D. | 会使石灰岩大量溶解,破坏自然风光 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Br的电子式: | |
| B. | HC1O的电子式: | |
| C. | 中子数为117、质子数为116的Lv原子:${\;}_{116}^{117}$Lv | |
| D. | HCl的电子式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com