
电解100mL含c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是()
A. 0.10 mol/L Ag+ B. 0.20 mol/L Zn2+
C. 0.20 mol/L Cu2+ D. 0.20 mol/L Pb2+
考点: 电解原理.
专题: 电化学专题.
分析: 在电解池中,阴极上阳离子的放电顺序是:银离子>铜离子>氢离子,只有放电顺序在H+前的才析出金属,根据电极反应结合电子守恒来计算即可.
解答: 解:Zn2+和Pb2+的放电顺序都在H+后面,所以含有这两种阳离子的盐溶液中,阴极上放出H2,而含有银离子和铜离子这两种阳离子的盐溶液中,Ag和Cu金属先在阴极析出.
A、0.10mol∕LAg+在氢离子之前放电,金属金属银的质量是 0.1mol/L×0.1L×108g/mol=1.08g;
B、Zn2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属;
C、铜离子先放电,100mL0.20mol∕LCu2+就会得到0.04mol电子,所以析出金属铜的质量为: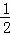 ×0.04mol×64g/mol=1.28g;
×0.04mol×64g/mol=1.28g;
D、Pb2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属.
所以析出金属质量最大的是0.20mol∕LCu2+.
故选C.
点评: 本题考查学生电解池上阴极上离子的放电顺序并结合电子守恒来计算析出金属的质量,综合性较强,难度较大.


科目:高中化学 来源: 题型:
下列装置的线路接通后,经过一段时间,溶液的pH值明显下降的是( )
|
| A. |
稀H2SO4 | B. |
NaOH溶液 | C. |
NaCl溶液 | D. |
CuSO4溶液 |
|
| E. |
CuSO4溶液 |
|
|
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C三种可溶性化合物,它们所含的离子是Ag+、CO32﹣、OH﹣、NO3﹣、Ba2+、Na+取相同质量的这三种物质,配成相同体积的三种溶液,测得其物质的量浓度大小依次为A>B>C,则A物质是()
A. AgNO3 B. Na2CO3 C. Ba(OH)2 D. NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在反应2MnO4﹣+5H2S+6H+=2Mn2++5S↓+8H2O中,电子转移总数为10e﹣还原剂为H2S还原产物为 ,当反应中有80gS析出时,有 mol MnO4﹣被还原
(2)“绿色试剂”双氧水可作为采矿业废液消毒剂,如果要消除采矿业废液中的氰化物(如KCN),化学反应方程式为:KCN+H2O2+H2O=KHCO3+NH3↑.
①反应中发生氧化反应的物质为 ;
②H2O2被称为绿色氧化剂的理由是 .
③用单线桥表示出该反应电子转移的方向和数目:KCN+H2O2+H2O=KHCO3+NH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是()
A. 未通电前上述镀锌装置可构成原电池,电镀过程是该电池的充电过程
B. 因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C. 电镀时保持电流恒定,升高温度不改变电解反应速率
D. 镀锌层破损后即对铁制品失去保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
在其他条件不变时,改变某一条件对反应:A2(g)+3B2(g)⇌2AB3(g)化学平衡状态的影响,得到如图变化规律(图中T表示温度,n表示物质的量),根据图示可得出的结论正确的是()

A. 正反应一定是放热反应
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2>T1,则正反应一定是吸热反应
D. b点时,平衡体系中A、B原子数之比可能接近1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
模型法是化学中把微观问题宏观化的最常见方法,对于2HBr(g)⇌H2(g)+Br2(g)反应.下列四个图中可以表示该反应在一定条件下为可逆反应的是()
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
T1℃时,向一体积不变的密闭容器中加入1mol A、2mol B和0.5mol C三种气体发生反应,各物质浓度随时间变化如图一所示,其中c(C)的变化未画出来,但t1时刻c(C)=c(D);图二为t2时刻后改变反应条件,A的转化率与温度、压强的关系
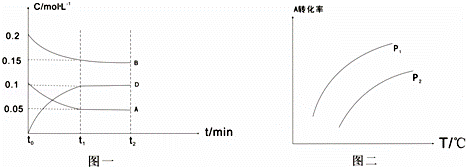
(1)t1=5min,则t0~t1阶段以C的浓度变化表示反应速率为v(C)= ,该反应的化学方程式为
(2)根据图二分析,温度升高,该反应的平衡常数将增大(填“增大”“减小”或“不变”),压强P1 P2 (填“>”“<”或“=”)
(3)若上述反应在T1℃、恒压下进行,A的转化率会减小(填“增大”“减小”或“不变”)
(4)在相同条件下(T1℃时,体积不变的密闭容器中),若起始时容器中加入2molD、 molB和 molC,才能达到t1时刻同样的平衡.
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电.电池负极反应为()
A. H2+2OH﹣=2H2O+2e﹣ B. O2+4H++4e﹣=2H2O
C. H2=2H++2e﹣ D. O2+2H2O+4e﹣=4OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com