
【题目】工业废气中氮氧化物(NO、NO2等,以通式NOx表示)是主要的大气污染物之一。
利用甲烷可消除NO2污染,CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和0.80molNO2,测得n(CH4)随时间变化的有关实验数据见下表:
N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和0.80molNO2,测得n(CH4)随时间变化的有关实验数据见下表:
组别 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 | 60 |
① | T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
② | T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 | 0.15 |
回答下列问题:
(1)组别①中,0~10min内NO2的平均降解速率为v(NO2)= ________________。
(2)由实验数据可知实验控制的温度T2_____T1(填“>”或“<”),请简述理由__________。
(3)组别②中,T2温度下40min时n(CH4)=________mol。该反应正反应为_______反应(填“吸热”或“放热”),理由是_____________________________。
(4)温度T1时CO2物质的量随时间的变化如下图,在图中画出温度T2时CO2物质的量随时间的变化曲线________。

(5)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为_________。
【答案】0.03mol/(Lmin) > 相同时间内,T2中参与反应的甲烷的物质的量较T1大 0.15 放热 温度越高CH4的转化率越低 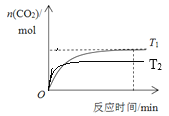 2xCO+2NOx
2xCO+2NOx![]() N2+2xCO2
N2+2xCO2
【解析】
(1)先计算①中,0~10min内V(CH4),然后根据速率比等于化学计量数的比计算V(NO2);
(2)在不同温度下,在相同时间内反应的CH4的多,化学反应速率快,结合温度对化学反应速率的影响分析判断;
(3)组别②中温度比①高,反应速率快,达到平衡所需要的时间短,①在40min时达到平衡,则组别②也达到了平衡,根据平衡温度分析;根据甲烷在T1、T2平衡含量分析温度对平衡移动的影响;
(4)升高温度,反应速率快,达到平衡所需要的时间短;且升高温度平衡逆向移动分析判断;
(5)CO与NOx反应,生成CO2、N2,根据原子守恒、电子守恒书写反应方程式。
(1)①中,0~10min内V(CH4)=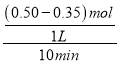 =0.015mol/(L·min),根据方程式CH4(g)+2NO2(g)
=0.015mol/(L·min),根据方程式CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)可知:V(NO2):V(CH4)=2:1,所以V(NO2)=2 V(CH4)= 0.03mol/(L·min);
N2(g)+CO2(g)+2H2O(g)可知:V(NO2):V(CH4)=2:1,所以V(NO2)=2 V(CH4)= 0.03mol/(L·min);
(2)根据表格数据可知:在相同时间内,T2中参与反应的甲烷的物质的量较T1大,说明反应速率T2>T1,由于在其它条件不变时,升高温度,化学反应速率加快,所以温度T2>T1;
(3)组别②中温度比①高,在40min时已经达到平衡,根据表格数据可知n(CH4)=0.15mol;
在温度为T1时CH4的平衡的物质的量为0.10mol;在温度为T2时CH4的平衡的物质的量为0.15mol.由于温度T2>T1,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,逆反应为吸热反应,所以该反应的正反应为放热反应;
(4)升高温度,反应速率快,达到平衡所需要的时间短。由于温度T2>T1,所以在温度为T2时先达到平衡。由于CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)的正反应是放热反应,所以升高温度,平衡逆向移动,平衡时CO2的物质的量比温度为T1时少所以温度与CO2的物质的量关系图像为:
N2(g)+CO2(g)+2H2O(g)的正反应是放热反应,所以升高温度,平衡逆向移动,平衡时CO2的物质的量比温度为T1时少所以温度与CO2的物质的量关系图像为: ;
;
(5)CO与NOx反应,生成CO2、N2,根据原子守恒、电子守恒可得:该反应的化学方程式为2xCO+2NOx![]() N2+2xCO2。
N2+2xCO2。


科目:高中化学 来源: 题型:
【题目】研究NO2、NO、CO等污染物的处理对建设美丽中国具有重要意义。
(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) ===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
①甲烷直接将NO2还原为N2的热化学方程式为________________________________。
②将CH4和NO2充入密闭容器中发生上述反应,该反应达到平衡后,为了提高反应速率的同时提高NO2的转化率,可采取的措施有__________(写一点即可)。
③利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(2)光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g)![]() 2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
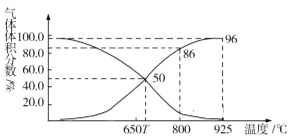
①T℃时,在容器中若充入稀有气体,平衡______移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡________移动。
②CO体积分数为40%时,CO2的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。800℃时用平衡分压代替平衡浓度表示平衡常数Kp=______(用含p总的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃A 的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
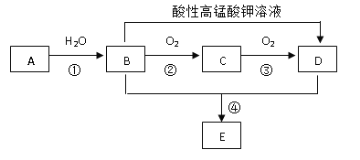
请回答下列问题:
(1)写出A的结构简式_________; A 、B 中官能团的名称和化学式__________;
(2)B→C的化学方程式为____________________,①,②反应类型为__________;
(3)B的结构式为____________________。若B中含有少量H2O,可加入_____________蒸馏除去。
(4)D与少量Na2CO3反应的离子方程式____________________。
(5)已知乙醇能发生如下脱水反应:CH3CH2OH+HOCH2CH3![]() CH3CH2OCH2CH3+ H2O,乙酸也能发生类似的脱水反应生成乙酸酐,写出该反应的化学方程式____________________。
CH3CH2OCH2CH3+ H2O,乙酸也能发生类似的脱水反应生成乙酸酐,写出该反应的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)![]() 2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如下图所示,在t1、t2、t3、t4时刻都只有一个条件发生改变。下列判断正确的是
2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如下图所示,在t1、t2、t3、t4时刻都只有一个条件发生改变。下列判断正确的是
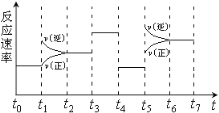
A. t6~t7阶段,C的百分含量最大
B. t2~t3阶段,A的转化率最小
C. t3时,改变因素一定是使用了催化剂
D. t5时,改变因素一定是升高了温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠投入5mL饱和澄清石灰水中,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动B.有气体生成
C.溶液底部有银白色物质生成D.溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃时,4L H2和O2的混合气体爆炸后恢复到原来状态,其体积变为3L。则原混合气体中H2和O2的体积比可能为( )
A.1:2B.1:3C.3:1D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A,B混合于2L的密闭容器中,发生反应3A(g)+B(g)![]() xC(g)+2D(g)。经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(Lmin)。试求:
xC(g)+2D(g)。经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(Lmin)。试求:
(1)x的值______;
(2)B的平均反应速率______;
(3)A的平衡浓度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、W 四种短周期元素的原子序数依次增大。其中 X 与 Y、Z、W 所形成的常见化合 物(10e 或 18e)在常温下均为气态,在元素周期表中 Z 与 W 相邻,Y 的最高价氧化物的水化物与其氢化 物反应生成盐,且 Y 的核电荷数与 W 的最外层电子数相同。
(1)Z 离子的结构示意图是_____。
(2) X、Y、W 可组成一种化合物,原子个数比为 4:1:1,该化合物的化学式是_____,其中含有的化学键 有_____。
(3)X 与 Y 所形成的分子的电子式为_____,它比同主族其他元素的氢化物沸点高的原因是______。
(4)请从 Z、W 的结构上说明 Z、W 两种元素非金属性的强弱_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是2SO3(g)![]() 2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
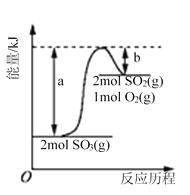
A. 该化学反应过程中既有能量的吸收又有能量的释放
B. 2SO3(g)![]() 2SO2(g)+O2(g) △H=-(a-b) kJ/mol
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2的能量比1 mol SO3的能量高
D. 若某容器内有2 mol SO3充分反应,吸收(a-b) kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com