
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在2 L密闭容器中进行,5s后,水蒸气的物质的量增加了6 mol,则此反应的平均速率可表示为( )
4NO(g)+6H2O(g)在2 L密闭容器中进行,5s后,水蒸气的物质的量增加了6 mol,则此反应的平均速率可表示为( )
A.ν(H2O)=0.6 mol/(L·s)B.ν(O2)=0.72 mol/(L·s)
C.ν(NO)==0.9 mol/(L·s)D.ν(NH3)=0.4 mol/(L·s)
【答案】AD
【解析】
计算出5s内用水蒸气表示的平均反应速率,然后利用化学计量数与化学反应速率成正比确定用一氧化氮、氧气、氨气表示的反应速率。
A. 5s后H2O的物质的量增加了6mol,则该时间段用H2O表示的平均反应速率为:v(H2O)=![]() =0.6mol/(L·s),故A正确;
=0.6mol/(L·s),故A正确;
B. 根据A选项ν(H2O)=0.6mol/(L·s),则ν(O2)=![]() ν(H2O)=0.5mol/(L·s),故B错误;
ν(H2O)=0.5mol/(L·s),故B错误;
C. 根据A选项ν(H2O)=0.6mol/(L·s),则ν(NO)=![]() ν(H2O)=
ν(H2O)=![]() ×0.6mol/(L·s)=0.4 mol/(L·s),故C错误;
×0.6mol/(L·s)=0.4 mol/(L·s),故C错误;
D. 根据A选项ν(H2O)=0.6mol/(L·s),则ν(NH3)=![]() ν(H2O)=
ν(H2O)=![]() ×0.6mol/(L·s)=0.4 mol/(L·s),故D正确;
×0.6mol/(L·s)=0.4 mol/(L·s),故D正确;
答案为AD。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】
(一) 现代铝的精炼研究方向是减低能耗。如图 :室温下通过电解在阴极沉积纯铝,A1Br3 在苯(简写 ArH)中可以生成[A12Br5ArH]+和 Br-。

(1)阳极的材料________;
(2)写出阴极沉积铝的电极方程式__________________________________________;
(二)邻硝基苯甲酸是重要的医院中间体,最新合成方法是邻硝基甲苯和高锰酸钾在相转移催化剂季铵盐(Q+X-)氧化、酸化合成,其原理如下:

相转移催化原理如下:

有关物质的物理性质如下表:
物质 | 邻硝基苯甲酸 | 高锰酸钾 | 苄基三乙基氯化铵(C6H5-CH2CH2)N(C2H5)3Cl | 聚乙二醇 | 四丁基溴化铵(C4H9)4NBr | NH4Cl |
水 | 难溶 | 易溶 | 可溶 | 任意比互溶溶 | 可溶 | 易溶 |
有机物 | 易溶 | 难溶 | 易溶 | 易溶 | 易溶 | 难溶 |
下列说法不合理的是________;
A.相转移催化剂作用主要决定于 Q+的物理化学性质
B.反应中为了防止温度剧烈升高,投料应该分批加入
C.Q+X-是通过增大反应接触面积提高反应速率
D.增大压强可以提高邻硝基甲苯氧化的反应限度
E.工业使用季铵盐(Q+X-)可以提高邻硝基苯甲酸产率
(2)四丁基溴化铵(C4H9)4NBr 萃取水中的高锰酸钾的方程式为:KMnO4(aq) +Q+X-(aq) →Q+ MnO4- (aq) +KX(aq),写出平衡常数 k 的表达式________________;设n(Q+X-):n(邻硝基甲苯)=x,理论证明当 x=5%邻硝基甲酸产率 y 得到最大值,请画出 y 随 x 变化的示意图________________ 。
(3)实验表明,当温度 100℃、反应时间 2.5h,n(KMnO4): n(邻硝基甲苯)=3:1,催化剂用量相同,Q+X-反应的催化效果如下:
相转移催化剂 | 苄基三乙基氯化铵 (C6H5-CH2CH2) N(C2H5)3Cl | 聚乙二醇 | 四丁基溴化铵 (C4H9)4NBr |
产率% | 46.7 | 20.0 | 53.1 |
苄基三乙基氯化铵比四丁基溴化铵催化效果差的原因_____________________________;工业生产不用聚乙二醇做催化剂的主要原因____________________________________ ;
(4)(C4H9)4NBr 为催化剂,邻硝基甲苯和高锰酸钾反应,测得溶液酸碱性对产率、反应时间影响如图 ,下列推测合理的是________。

A.溶液碱性强产率降低是因为季铵盐发生水解反应
B.pH=2 高锰酸钾一定发生副反应
C.选择 pH=7、适当升温可以提高产率
D.工业可以选择浓硝酸替代高锰酸钾做氧化剂,减缓对设备的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为100mL浓度均为1molL的 NaClO、NaOH、CH3COONa的三种溶液中通入CO2,测得各溶液中n(HCO3-)的变化如下:

下列分析正确的是
A. CO2通入 NaClO溶液的反应:2ClO-+CO2+H2O=CO32-+2HClO
B. CO2通入 CH3COONa溶液的反应:CO2+H2O+ CH3COO-=HCO3-+ CH3COOH
C. 通入n(CO2)=0.06mol,NaOH溶液的反应:2OH-+CO2=CO32-+H2O
D. 通入n(CO2)=0.06mol,三种溶液中:n(HCO3-)+n(CO32-)+n(H2CO3)=0.06mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图可设计成多种用途的电化学装置,下列说法错误的是

A. a与电源正极相连时,铜做阳极
B. a和b用导线连接时,锌做负极
C. a和b用导线连接时,铜片上发生的反应为:2H++2e -=H2↑
D. a与电源正极相连可以保护锌片,称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种轻金属,被称为金属界的“万金油”,应用范围极为广阔。含铝的化合物如氧化铝、氢氧化铝等在工业上用途十分广泛。
完成下列填空:
(1)铝是活泼金属,在干燥空气中铝的表面立即形成厚约5 nm的致密氧化膜,写出除去氧化膜的一种方法____________________(用方程式表示)。
(2)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,解释氢氧化铝能做阻燃剂的原因_____________________(用方程式说明);写出Al(OH)3的电离方程式________________。
(3)明矾(KAl(SO4)2·12H2O)的水溶液呈_______性(选填“酸”、“碱”或“中”),溶液中离子浓度大小顺序为_____________________。将明矾溶液与小苏打溶液混合会产生白色沉淀和气体,请用平衡移动原理解释该现象。_______________________________________
(4)碳热还原氯化法从铝土矿中炼铝具有步骤简单、原料利用率高等优点,其原理如下:
Ⅰ. Al2O3(s) + AlCl3(g) + 3C(s) ![]() 3AlCl(g) + 3CO(g) – 1486 kJ
3AlCl(g) + 3CO(g) – 1486 kJ
Ⅱ. 3AlCl(g) ![]() 2Al(l) + AlCl3(g) + 140 kJ
2Al(l) + AlCl3(g) + 140 kJ
① 写出反应Ⅰ的化学平衡常数表达式K=_____________,升高温度,K_______(填增大、减小、不变)。
② 写出反应Ⅱ达到平衡状态的一个标志_________________________________;
结合反应Ⅰ、Ⅱ进行分析,AlCl3在炼铝过程中的作用可以看作______________。
③ 将1mol氧化铝与3mol焦炭的混合物加入2L反应容器中,加入2mol AlCl3气体,在高温下发生反应Ⅰ。若5min后气体总质量增加了27.6g,则AlCl的化学反应速率为_________ mol/(L·min)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分前四周期元素的性质或原子结构如下表:

(1)B单质分子中,含有________个![]() 键和__________个
键和__________个![]() 键,元素B的气态氢化物的空间型为________________。
键,元素B的气态氢化物的空间型为________________。
(2)C单质的熔点____________A单质的熔点(填“高于”或“低于”),其原因是:_______________
(3)写出元素D基态原子的电子排布式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是

A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如图一
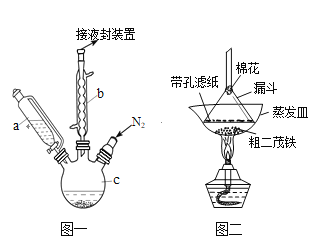
已知:①二茂铁熔点是173℃,在100℃时开始升华;沸点是249℃。
②制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6= Fe(C5H5)2+2KCl+2H2O
实验步骤为:
①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(C5H6, 密度为0.95g/cm3),搅拌;
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25mL装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是________________________.
(2)步骤①中通入氮气的目的是____________________________________________________.
(3)仪器c的适宜容积应为(选编号):_________
①100mL ②250mL ③500mL
(4)步骤⑤用盐酸洗涤的目的是__________________________________________________
(5)步骤⑦是二茂铁粗产品的提纯,该过程在图二中进行,其操作名称为_________;该操作中棉花的作用是______________________________________________________.
(6)为了确认得到的是二茂铁,还需要进行的一项简单实验是__________________________;若最终制得纯净的二茂铁4.3g,则该实验的产率为____________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为人工肾脏采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2)的原理。请回答下列问题:

(1)电源的负极为____(选填“A”或“B”)。
(2)阳极室中发生的反应依次为________________、_________________________。
(3)电解结束后,阴极室溶液的pH与电解前相比将___(选填“降低”、“增大”或“不变”)。
(4)若两极共收集到标准状况下气体6.72 L,则除去的尿素为__g(忽略气体的溶解)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com