
| A. | 碘水加到溴化钠溶液中:2Br-+I2═2I-+Br2 | |
| B. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 大理石溶于醋酸:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+═2Fe3++2Cl- |
分析 A.遵循电子、电荷守恒;
B.生成的HClO在离子反应中保留化学式;
C.反应生成醋酸钙和水、二氧化碳;
D.少量氯气,只氧化亚铁离子.
解答 解:A.碘水加到溴化钠溶液中的离子反应为2Br-+I2═2I-+Br2,故A正确;
B.氯气溶于水的离子反应为Cl2+H2O═H++Cl-+HClO,故B错误;
C.大理石溶于醋酸的离子反应为CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故C正确;
D.FeBr2溶液中通入少量的Cl2的离子反应为Cl2+2Fe2+═2Fe3++2Cl-,故D正确;
故选B.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;试题培养了学生的灵活应用能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-802.3 kJ•mol-1 | |
| C. | 2CO(g)+1O2(g)═2CO2(g)△H=-566 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
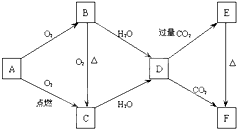 如图所示,A、B、C、D、E、F为金属钠或钠的化合物.
如图所示,A、B、C、D、E、F为金属钠或钠的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | NaHC03固体 | Na2C03固体 | / | 加热 |
| B | Al2O3 | Fe2O3 | 盐酸 | 过滤 |
| C | KBr溶液 | Br2 | KOH溶液 | 分液 |
| D | Cl2 | HCl | 饱和食盐水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

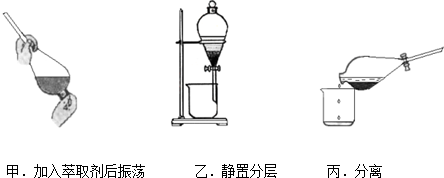
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
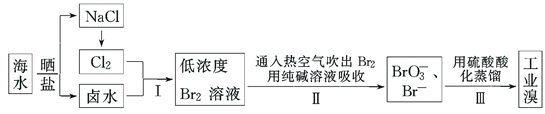
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能在水溶液电离出H+的物质是酸 | |
| B. | 氧化还原反应中所有元素的化合价均有升降 | |
| C. | 在化学反应中,得电子越多的氧化剂,其氧化性就越强 | |
| D. | 氧化还原反应的实质是电子的转移(得失或偏移) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com