
 ,利用均摊法计算.
,利用均摊法计算. ,Cu原子处于面心,所以晶胞中Cu原子个数为6×
,Cu原子处于面心,所以晶胞中Cu原子个数为6×| 1 |
| 2 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
 20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学用NaCl固体配制100mL 2mol/L的NaCl溶液,请回答下列问题:
某同学用NaCl固体配制100mL 2mol/L的NaCl溶液,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 单质硼有无定形和晶体两种,参考下列数据
单质硼有无定形和晶体两种,参考下列数据| 金刚石 | 晶体硅 | 晶体硼 | |
| 熔点/K | >3550 | 1410 | 2573 |
| 沸点/K | 4827 | 2628 | 2823 |
| 摩氏硬度 | 10 | 6.5 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
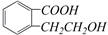 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质: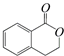 ②
②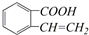 ③
③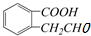 ④
④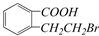 ,
,| A、取代、消去、酯化、加成 |
| B、酯化、消去、氧化、取代 |
| C、酯化、取代、氧化、取代 |
| D、消去、消去、氧化、取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、d>b>a>c |
| B、b>a>d>c |
| C、b>d>a>c |
| D、c>b>d>a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com