
【题目】试回答下列问题:
(1)9g水的物质的量是mol,含有mol 氢原子,含有个电子.
(2)等物质的量的SO2 和SO3 所含的原子个数之比是 , 质量比是 .
(3)0.4molNH3 中所含氢原子数与克水中所含氢原子数相等.
(4)质量分数为49%的硫酸溶液,其密度为1.4g/cm3 , 则其物质的量浓度为 .
(5)在aL Al2(SO4)3 和(NH4)2SO4 的混合溶液中加入b mol BaCl2 , 恰好使溶液中的SO42﹣完全沉淀;若加入足量NaOH 并加热可得到c mol NH3 , 则原溶液中Al3+的物质的量浓度为 .
【答案】
(1)0.5;1;3.01×1024
(2)3:4;4:5
(3)10.8
(4)7mol/L
(5)![]() mol/L
mol/L
【解析】解:(1)9g 水的物质的量是 ![]() =0.5mol,含有氢原子为0.5mol×2=1mol,含有电子数目为0.5mol×10×6.02×1023mol﹣1=3.01×1024 , 所以答案是:0.5;1;3.01×1024;(2)SO2 和SO3 分子分别含有3个、4个原子,等物质的量的SO2 和SO3 所含的原子个数之比3:4,根据m=nM可知,二者质量比是64g/mol:80g/mol=4:5,所以答案是:3:4;4:5;(3)与0.4mol NH3 中所含氢原子数相等的水的物质的量为
=0.5mol,含有氢原子为0.5mol×2=1mol,含有电子数目为0.5mol×10×6.02×1023mol﹣1=3.01×1024 , 所以答案是:0.5;1;3.01×1024;(2)SO2 和SO3 分子分别含有3个、4个原子,等物质的量的SO2 和SO3 所含的原子个数之比3:4,根据m=nM可知,二者质量比是64g/mol:80g/mol=4:5,所以答案是:3:4;4:5;(3)与0.4mol NH3 中所含氢原子数相等的水的物质的量为 ![]() =0.6mol,故水的质量为0.6mol×18g/mol=10.8g,所以答案是:10.8;(4)根据c=
=0.6mol,故水的质量为0.6mol×18g/mol=10.8g,所以答案是:10.8;(4)根据c= ![]() 可知,质量分数为49%、密度为1.4g/cm3的硫酸溶液,其物质的量浓度为
可知,质量分数为49%、密度为1.4g/cm3的硫酸溶液,其物质的量浓度为 ![]() mol/L=7mol/L,所以答案是:7mol/L;(5)由混合溶液中加入bmolBaCl2 , 恰好使溶液中的SO42﹣离子完全沉淀,则: SO42﹣+Ba2+═BaSO4↓
mol/L=7mol/L,所以答案是:7mol/L;(5)由混合溶液中加入bmolBaCl2 , 恰好使溶液中的SO42﹣离子完全沉淀,则: SO42﹣+Ba2+═BaSO4↓
bmol bmol
c(SO42﹣)= ![]() =
= ![]() mol/L,
mol/L,
由加入足量强碱并加热可得到1molNH3 , 则:
NH4++OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
cmol cmol
c(NH4+)= ![]() =
= ![]() mol/L,
mol/L,
又溶液不显电性,设原溶液中的Al3+浓度为x,由电荷守恒可知,
x×3+ ![]() mol/L×1=
mol/L×1= ![]() mol/L×2,
mol/L×2,
解得x= ![]() mol/L,
mol/L,
所以答案是: ![]() mol/L.
mol/L.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】某工厂为了生产耐高温植酸酶饲料添加剂,开展了产该酶菌株的筛选、酶的固定化及其特性分析研究,其流程如下图所示。请回答:
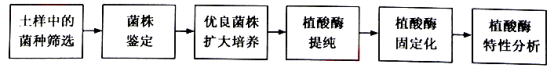
(1)上壤悬液泞先经80℃处理15分钟,其目的是筛选出
(2)在无菌条件下,将经过处理的土壤悬液进行 ,然后涂布于含有植酸钠的固体培养基上。培养后观察到 ,其周围出现透明水解圈,圈的直径大小与 强弱相关。
(3)筛选获得的菌株经鉴定后,将优良菌株进行液体扩大培养。培养时需要振荡,其主要目的是 。液体培养基与固体培养基相比不含有的成分是 。
(4)在合适条件下,将提纯的植酸酶与海藻酸钠混合后,滴加到一定浓度的钙离子溶液中,使液滴形成凝胶固体小球。该过程是对酶进行 。
A.吸附 B.包埋 C.装柱 D.洗涤
(5)温度与植酸酶相对酶活性的关系如图所示。下列叙述错误的是 。
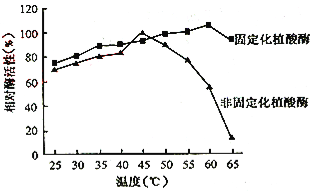
A.测试温度中,固定化与非固定化植酸酶的最适温度分别为60℃和45℃
B.测试温度范围内,固定化植酸酶的相对酶活性波动低于非固定化植酸酶
C.固定化与非固定化植酸酶相比,相对酶活性在80%以上时的温度范围较宽
D.65℃时固定化与非固定化植酸酶的相对酶活性因蛋白质变性而位于最低点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可以连续使用一个月.已知该电池的总反应式为:2CH3OH+3O2+4KOH ![]() 2K2CO3+6H2O 请填空:
2K2CO3+6H2O 请填空:
(1)放电时:负极的电极反应式为 .
(2)通入甲醇一端的电极是极,电池在放电过程中溶液的pH将(填“上升”、“下降”或“不变”).
(3)若在常温、常压下,1g CH3OH燃烧生成CO2和液态水时放出22.68kJ的热量,表示该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酶在生产生活中具有广泛的应用,图甲表示过氧化氢酶催化过氧化氢水解的模型,图乙表示在最适温度和pH条件下,过氧化氢酶的催化速率与过氧化氢量的关系。请回答下列问题:

(1)过氧化氢酶在_________中合成,图1模型能很好地解释了酶具有___________(特性)。
(2)图2中,如果pH分别升高和降低,则催化速率将分别_______、_______(填“升高”“不变”或“降低”)。
(3)不能用过氧化氢酶来探究温度对酶活性的影响,请解释其原因:_________________。
(4)初步测定过氧化氢酶的最适pH在6.0—8.0之间,简要写出测定过氧化氢酶最适pH的实验思路_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在人类生产、生产中发挥着重要的作用.
(1)钠、铝、铁三种金属元素所形成的各种氧化物中具有强氧化性的是(填化学式,下同);适宜做耐火材料的是 .
(2)若Na2CO3粉末中混有少量NaHCO3杂质,最适宜的除杂方法是 , 反应的化学方程式 .
(3)取少量FeCl2溶液,按如图所示操作,使其跟NaOH溶液反应.可观察到的实验现象是 . 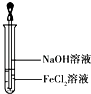
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是(填序号).
A.有铜无铁
B.有铁无铜
C.铁、铜都有
D.铁、铜都无.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10﹣6 , 常温下CaSO4在水中的沉淀溶解平衡曲线如图,下列判断错误的是( ) 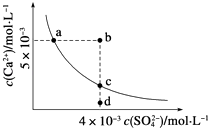
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO42﹣)一定不等于3×10﹣3 molL﹣1
D.向d店溶液中加入适量CaCl2固体可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.9g由Mg、Al,Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7g.另取等质量的合金溶于过量稀硝酸中,生成了6.72L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为( )
A.22.1g
B.27.2g
C.30g
D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、Cl﹣、SO ![]()
B.H+浓度为1×10﹣13mol?L﹣1的溶液中,Na+、K+、Cl﹣、NO ![]()
C.AlO ![]() 浓度为0.1 mol?L﹣1的溶液中:Na+、K+、HSO
浓度为0.1 mol?L﹣1的溶液中:Na+、K+、HSO ![]() 、Cl﹣
、Cl﹣
D.室温下,pH=1的溶液中:Na+、Fe3+、NO ![]() 、SiO
、SiO ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com