
| A. | 将2-氯丙烷与NaOH的醇溶液共热制备CH3-CH═CH2 | |
| B. |  与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 | |
| C. | 用分液法分离苯和液溴的混合物 | |
| D. | 向卤代烃水解后的溶液中直接加入硝酸银溶液,可以确定卤代烃中的卤元素 |
分析 A.与-Cl相连的C的邻位C上有H原子,能发生消去反应;
B.-COOH、酚-OH均与NaOH反应;
C.苯与溴苯的沸点不同;
D.卤代烃水解后溶液为碱性.
解答 解:A.与-Cl相连的C的邻位C上有H原子,能发生消去反应,可将2-氯丙烷与NaOH的醇溶液共热制备CH3-CH═CH2,故A正确;
B.-COOH、酚-OH均与NaOH反应,则乙酰水杨酸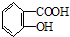 与NaOH溶液反应不能制备
与NaOH溶液反应不能制备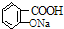 ,故B错误;
,故B错误;
C.苯和液溴互溶,不分层;苯与溴苯的沸点不同,则用蒸馏法分离苯和溴苯的混合物,故C错误;
D.卤代烃水解后溶液为碱性,应水解后加硝酸至酸性,再加入硝酸银溶液,可以确定卤代烃中的卤元素,故D错误;
故选A.
点评 本题考查化学实验方案的评价,侧重有机物性质的考查,注意有机物的反应类型与反应条件、官能团及性质的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量是98g | B. | 1mol N2的质量为28g/mol | ||
| C. | 阿伏伽德罗常数用符号为NA表示 | D. | 1mol氧的质量等于16g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件均未列出).
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件均未列出).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铁能导电,所以铁是电解质 | |
| B. | 稀盐酸能导电,所以盐酸是电解质 | |
| C. | 硫酸溶液能导电,所以硫酸是电解质 | |
| D. | Na2O溶于水能导电,但Na2O不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com