
| 选项 | A | B | C | D |
| 晶体名称 | 碘化钾 | 干冰 | 石墨 | 碘 |
| 晶体中 的粒子 | 阴、阳离子 | 分子 | 原子 | 分子 |
| 粒子间 的作用 | 离子键 | 分子间 作用力 | 共价键 | 分子间 作用力 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碘化钾为离子晶体,组成微粒为离子,存在离子键;
B.干冰为分子晶体,存在分子间作用力;
C.石墨属于混合晶体,存在分子间作用力和共价键;
D.碘为分子晶体,且为双原子分子,晶体内存在的作用力为范德华力.
解答 解:A.碘化钾为离子晶体,组成微粒为离子,组成晶体粒子间的结合力为离子键,故A正确;
B.干冰为分子晶体,组成微粒为分子,分子之间的结合力为范德华力,也叫做分子间作用力,故B正确;
C.石墨属于混合晶体,存在分子间作用力和共价键,故C错误;
D.碘为分子晶体,且为双原子分子,晶体内存在的作用力为范德华力,故D正确;
故选C.
点评 本题考查晶体的结构、组成以及微粒间作用力,题目难度不大,明确常见晶体的类型及含有微粒间作用力为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | A的分子式为C2H4O3 | |
| B. | A的结构简式为HOCH2COOH | |
| C. | A分子中的官能团有两种 | |
| D. | 1 mol A与足量的单质Na反应时放出H2的物质的量为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
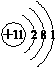 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
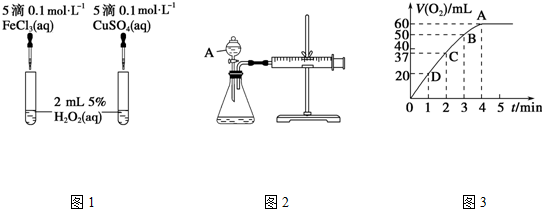
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中存在两种电离平衡 | |
| B. | 不同原子之间形成的共价键不一定是极性共价键 | |
| C. | 向久置于空气中的Na2SiO3、NaOH、CaCl2、漂白粉溶液里加足量盐酸,都能产生气体 | |
| D. | 将少量酸化的FeCl2溶液滴入过氧化氢溶液中,溶液变黄,并产生大量的气泡. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏目的是将含碳原子数较少的烃先气化经冷凝而分离出来 | |
| B. | 石油经过常、减压分馏、裂化等工序炼制后即能制得纯净物 | |
| C. | 石油的裂化是把相对分子质量较大的烃分子断裂为相对分子质量较小的烃分子 | |
| D. | 工业上通过石油裂解制取大量乙烯、丙烯,乙炔;通过石油催化重整获取芳香烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com