
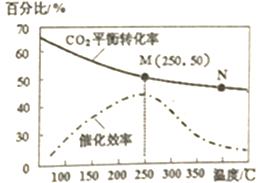
 一定条件下合成乙烯6H2(g)+2C02(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H20(g);己知温度对C02的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
一定条件下合成乙烯6H2(g)+2C02(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H20(g);己知温度对C02的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)一定小于v(N) | |
| B. | 平衡常数:KM<KN | |
| C. | 催化剂对CO2的平衡转化率没有影响 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
分析 A、温度升高化学反应速率加快,催化剂的催化效率降低;
B、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动;
C、催化剂只影响反应速率,不影响平衡移动和转化率;
D、设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%,据此列三段式计算.
解答 解:A、化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v(M)有可能小于v(N),故A错误;
B、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故B错误;
C、催化剂只影响反应速率,不影响平衡移动和转化率,故C正确;
D、设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%
所以有6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g)
开始 3 1 0 0
转化 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
所以乙烯的体积分数为$\frac{0.25}{1.5+0.5+0.25+1}$×100%=7.7%,故D正确;
故选CD.
点评 本题考查了图象分析化学反应速率的影响因素、平衡计算、平衡移动等,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 苯和溴水共热 | B. | 光照甲苯与氯气的混合物 | ||
| C. | 溴乙烷与NaOH溶液共热 | D. | 乙烷通入溴的四氯化碳溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按照规定对生活废弃物进行分类放置,实现资源再利用 | |
| B. | 防治环境污染、开发智能软件、合成新材料等,都属于化学研究的领域 | |
| C. | 利用人工光合成反应,将二氧化碳转化为碳氢化合物作燃料,属于低碳技术 | |
| D. | 液晶态介于晶体状态和液态之间,液晶具有有一定程度的晶体的有序性和液体的流动性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 浓硫酸的还原产物是SO2 | |
| B. | 该装置可随时控制反应的发生或停止 | |
| C. | ①中有白色固体生成,加水后溶液呈蓝色 | |
| D. | ②中盛放Ba(NO3)2溶液可吸收SO2,防止空气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023个碳原子的质量为1 g | |
| B. | 钠原子的摩尔质量为23 g | |
| C. | HCl的摩尔质量等于6.02×1023个HCl分子的质量 | |
| D. | Na2O2的摩尔质量为78 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
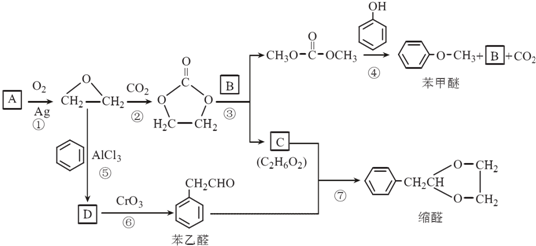
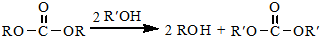
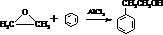 .
.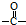 结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1.
结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1.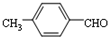 ,
,
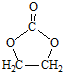 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备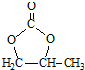 的合成路线(注明必要的反应条件).
的合成路线(注明必要的反应条件).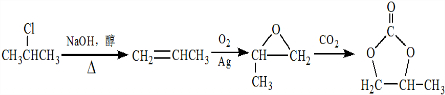 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com