
| A. | Na•+Cl:→[Na]+[•Cl:]- | B. | H2•+•O•→H:O:H | ||
| C. |  →Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-Na+ →Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-Na+ | D. |  →H:F →H:F |
分析 A.氯化钠属于离子化合物,存在电子得失,氯离子电子数不正确;
B.水中O原子周围8个电子;
C.硫化钠属于离子化合物,存在电子得失;
D.HF是共价化合物,不存在电子得失.
解答 解:A.NaCl为离子化合物,用电子式表示形成过程为 ,故A错误;
,故A错误;
B.H2O为共价化合物,O原子达到8电子稳定结构,用电子式表示形成过程为 ,故B错误;
,故B错误;
C.硫化钠属于离子化合物,存在电子得失,用电子式表示形成过程为 →Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-Na+,故C正确;
→Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-Na+,故C正确;
D.HF是共价化合物,不存在电子得失,用电子式表示形成过程为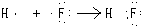 ,故D错误.
,故D错误.
故选C.
点评 本题考查了用电子式书写化合物的性质过程,明确化合物中存在的化学键是解本题关键,难点是用电子式表示化合物的形成过程,注意把握书写方法.


科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它有酸性,能与纯碱溶液反应 | |
| B. | 它可以水解,水解产物只有一种 | |
| C. | 1 mol该有机物最多能和7 mol NaOH反应 | |
| D. | 该有机物能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:| 实验编号 | 待测液体积/mL | 所消耗氢氧化钠标准液的体积/mL |
| 1 | 25.00 | 26.30 |
| 2 | 25.00 | 26.34 |
| 3 | 25.00 | 19.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应是吸热反应 | B. | 正反应是放热反应 | ||
| C. | 升高温度平衡向正反应方向移动 | D. | 以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑦ | B. | ②⑥⑦ | C. | ①④⑧ | D. | ②⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com